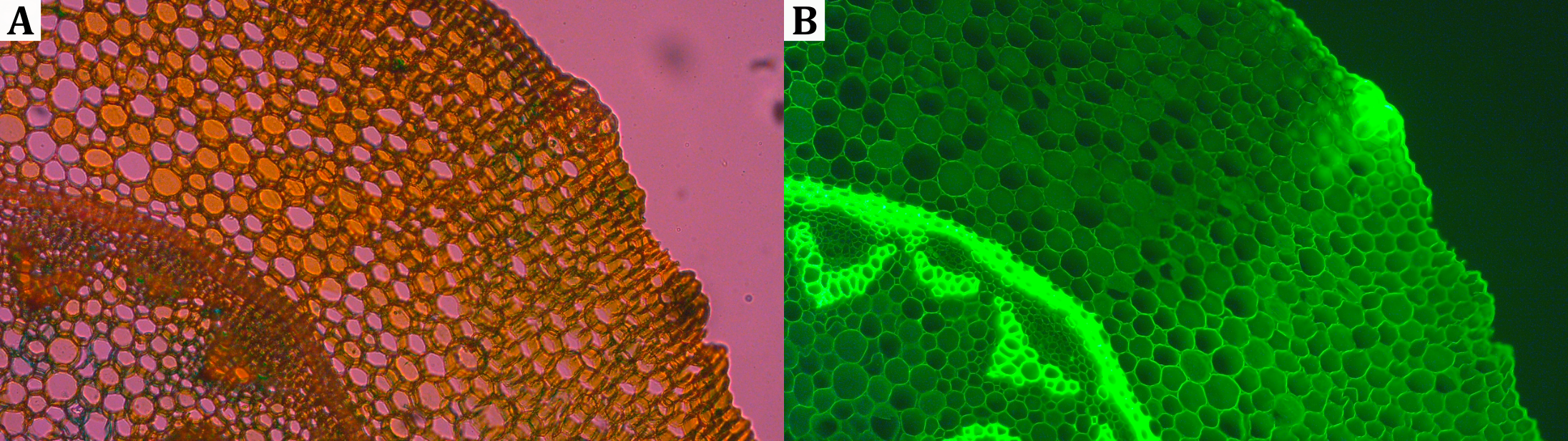
(A) Mikroskopische Aufnahmen des Sprossquerschnitts eines Maiglöckchens (Convallaria majalis), (B) Eigenfluoreszenz nach Anregung mit UV-Licht.
In diesem Themenfeld finden Sie acht Experimente als Exkurs-Mögleichkeit zu den Hintergründen der Fluoreszenz und der Fluoreszenzmikroskopie:
- Strukturelle Abhängigkeit der Fluoreszenz
- Anregung von Fluoreszenzfarbstoffen
- Knicklichter – alternative Anregungsmöglichkeiten von Fluoreszenzfarbstoffe
- Sensitivität von Fluoreszenzfarbstoffen
- Quenching-Effekt
- Self-quenching von Pyranin
- Förster-Resonanztransfer (FRET)
- Fluorochromierung von Pflanzenbestandteilen
Bitte beachten Sie bei den Experimenten zum Quenching die Anmerkungen zur Deutung der Experimente. Zusätzlich bietet sich in diesem Exkurs die Betrachtung des Modellexperiments Fluoreszenzmarkierte Fusion von Seifenblasen aus dem Themenfeld 5 – Untersuchungsmethoden in der Membranforschung an.
Strukturelle Abhängigkeit der Fluoreszenz
Dieses Experiment kann u. a. im Unterricht eingesetzt werden, um die auftretende Fluoreszenz didaktisch reduziert auf die eingeschränkten Rotationsbewegungen innerhalb des Morinmoleküls zurückzuführen.
Geräte und Chemikalien:
3 Bechergläser (50 mL), Tüpfelplatte, Pasteurpipetten, Spatel, UV-Lampe, demin. Wasser, Aluminiumchlorid Hexahydrat (GHS05), Morin (GHS09), Ethanol (GHS02, GHS07), Essigsäurelösung (1 M; GHS05).
Versuchsdurchführung:
In einem Becherglas wird eine Spatelspitze Morin in 10 mL Ethanol gelöst. Auf eine Tüpfelplatte werden in je ein Feld die Morinlösung, eine Aluminiumchloridlösung sowie Ethanol gegeben und alle drei mit einem Tropfen Essigsäurelösung angesäuert. Anschließend werden sowohl die Aluminiumchloridlösung als auch das Ethanol mit etwas Morinlösung versetzt. Schließlich werden die Lösungen unter UV-Licht betrachtet.
Beobachtung:
Bei Zugabe der Morinlösung intensiviert sich die gelbe Färbung der Aluminiumchloridlösung. Unter UV-Licht ist eine blau-grüne Fluoreszenz zu beobachten, wobei alle anderen Lösungen keine Fluoreszenz zeigen (siehe Abbildung).
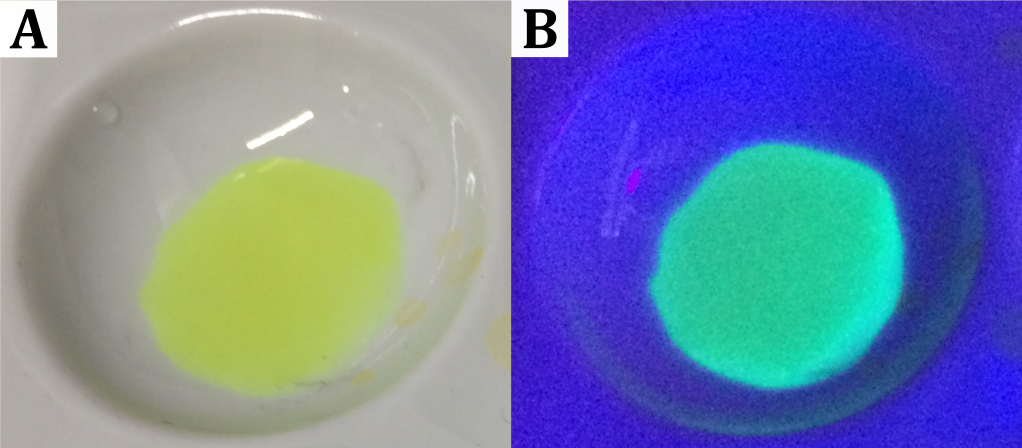
Abbildung: (A) Gelbe Färbung der Lösung bei Tageslicht, (B) blau-grüne Fluoreszenz unter UV-Licht.
Deutung:
Morin bildet in Anwesenheit von Aluminiumionen einen Chelatkomplex, an dem u. a. auch die Resorcingruppe beteiligt ist. Aufgrund der Chelatierung wird die Rotationsfähigkeit des Resorcins eingeschränkt (siehe Abbildung B, rot markierte Bindungsstellen), so dass eine strahlungslose Desaktivierung nur eingeschränkt möglich ist. Entsprechend erfolgt die Energieabgabe in Form von strahlender Desaktivierung, die als Fluoreszenz wahrgenommen werden kann.
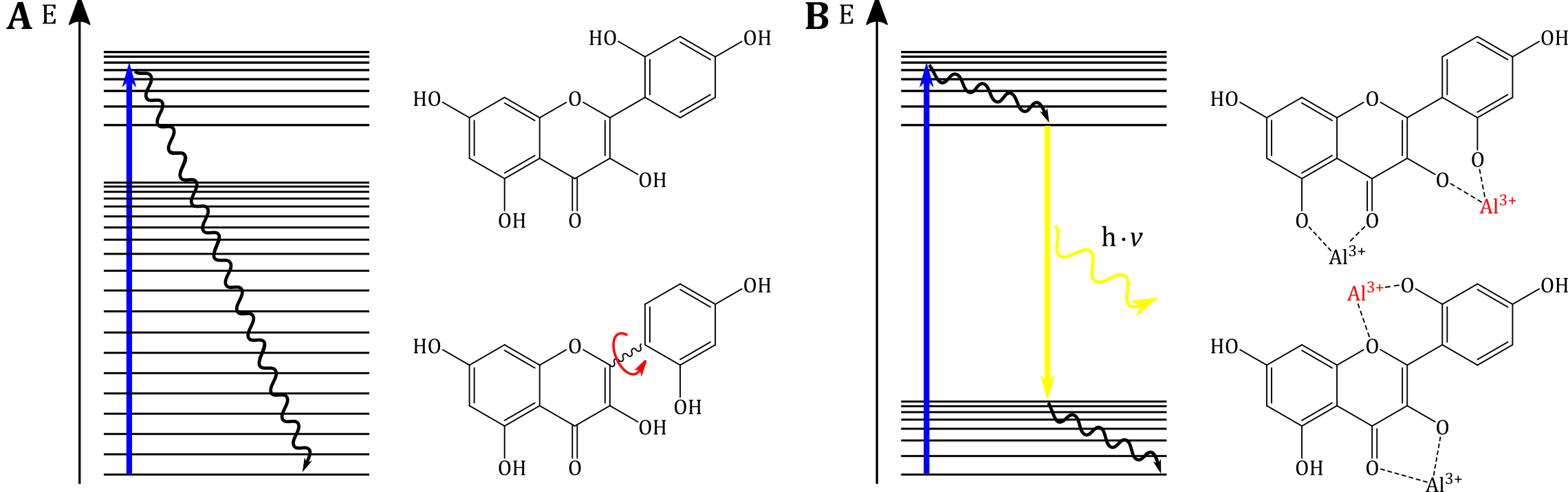
Abbildung: (A) Das Morinmolekül ist zunächst sterisch nicht gehindert, so dass eine Abregung über Schwingungsrelaxation möglich ist. (B) Bzgl. der Chelatierung mit Aluminiumionen werden verschiedene Bindungsstellen vorgeschlagen. Die rot markierten Bindungsstellen verhindern eine Rotation und verringern die Schwingungszustände, so dass eine Abregung mittels Fluoreszenzemission erfolgt.
Anmerkungen zur Deutung des Experiments:
Morin gehört zur Gruppe der Flavonoide, die in der Natur eine wichtige Rolle als Blütenfarbstoffe spielen. Es bildet in Anwesenheit von Aluminiumionen aber auch anderen Zentralteilchen wie Zink-, Kupfer-, Eisen- oder Cadmiumionen Chelatkomplexe aus, die z. T. charakteristisch fluoreszieren. Die Fluoreszenz wird dabei in der Literatur auf intramolekulare Protonentransfers im elektronisch angeregten Zustand (Excited State Intramolecular Proton Transfer, ESIPT) zurückgeführt (Höfener et al., 2013). Für die schulische Verwendung ist jedoch eine didaktische Reduzierung auf die Einschränkung von Rotationsbewegungen innerhalb des Morinmoleküls aufgrund der Chelatierung ausreichend. Diesbezüglich lassen sich in der Literatur verschiedene Vorschläge für die Bindungsstellen sowie die Stöchiometrie der Komplexe in Abhängigkeit vom Lösungsmittel, pH-Wert und dem Zentralatom finden (Jamali et al., 2012; Oter & Aydogdu, 2011; Roy et al., 2016; Paulke et al., 2006). Anhand dieser möglichen Bindungsstellen können sterische Hinderungen bezüglich Rotationsbewegungen diskutiert und im Zusammenspiel mit dem oben gezeigten Beispiel von Phenolphthalein und Fluorescein die Bedeutung des Rotationsvermögens hinsichtlich der Fluoreszenzeigenschaft von Molekülen erarbeitet werden.
Literatur:
- Gerdes, E. (2001). Qualitative anorganische Analyse: Ein Begleiter für Theorie und Praxis (2., korrigierte und überarb. Aufl. 1998, Nachdr). Berlin: Springer.
- Höfener, S., Kooijman, P. C., Groen, J., Ariese, F., & Visscher, L. (2013). Fluorescence behavior of (selected) flavonols: A combined experimental and computational study. Physical Chemistry Chemical Physics : PCCP, 15(30), 12572–12581. DOI: 10.1039/c3cp44267e.
- Jamali, A. A., Tavakoli, A., & Ezzati Nazhad Dolatabadi, J. (2012). Analytical overview of DNA interaction with Morin and its metal complexes. European Food Research and Technology, 235(3), 367–373. DOI: 10.1007/s00217-012-1778-8.
- Oter, O., & Aydogdu, S. (2011). Determination of aluminum ion with morin in a medium comprised by ionic liquid-water mixtures. Journal of Fluorescence, 21(1), 43–50. DOI: 10.1007/s10895-010-0688-z.
- Roy, A. S., Samanta, S. K., Ghosh, P., Tripathy, D. R., Ghosh, S. K., & Dasgupta, S. (2016). Cell cytotoxicity and serum albumin binding capacity of the morin-Cu(ii) complex and its effect on deoxyribonucleic acid. Molecular BioSystems, 12(9), 2818–2833. DOI: 10.1039/C6MB00344C.
- Paulke, A., Schubert-Zsilavecz, M., & Wurglics, M. (2006). Determination of St. John's wort flavonoid-metabolites in rat brain through high performance liquid chromatography coupled with fluorescence detection. Journal of Chromatography. B, Analytical Technologies in the Biomedical and Life Sciences, 832(1), 109–113. DOI: 10.1016/j.jchromb.2005.12.043.
- von Hoff, E. (2020). Entwicklung und Evaluation von Konzepten und Formaten zum Wissenstransfer von der Forschung in die Schule und Öffentlichkeit - Am Beispiel des SFB 803 (Dissertation). Georg-August-Universität Göttingen, Göttingen. Abrufbar unter http://hdl.handle.net/21.11130/00-1735-0000-0005-14C7-4.
Anregung von Fluoreszenzfarbstoffen
Die Anregung von Fluoreszenzfarbstoffen mit Laserstrahlen verschiedener Wellenlängen ist aufgrund ihrer Reproduzierbarkeit flexibel anwendbar. Jedoch muss ein sorgsamer Umgang mit den Laserpointern gewährleistet sein.
Geräte und Chemikalien:
4 Schnappdeckelgläser, UV-Lampe, 3 Laserpointer (violett, grün, rot), 4 Lösungen mit blauer, grüner, gelber und roter Fluoreszenz (z. B. Textmarkerlösungen, Chlorophylllösung)
Versuchsdurchführung:
Vier Lösungen die blau, grün, gelb bzw. rot fluoreszieren werden nacheinander jeweils mit UV-Licht sowie einem violetten, grünen und roten Laserstrahl durchleuchtet.
Beobachtung:
Unter UV-Licht fluoreszieren alle Lösungen mit einer bestimmten Farbe. Werden die Lösungen mit einem violetten Laserstrahl durchleuchtet, ist bei allen vier Lösungen entsprechend ihrer Farbe unter UV-Licht der Strahlengang als Fluoreszenz wahrzunehmen. Wird ein grüner Laserstrahl verwendet, ist lediglich bei den Lösungen die gelb und rot fluoreszieren eine Fluoreszenz zu sehen. Unter Bestrahlung mit einem roten Laserstrahl ist in keiner der Lösungen eine Fluoreszenz wahrnehmbar (vgl. Abbildung).
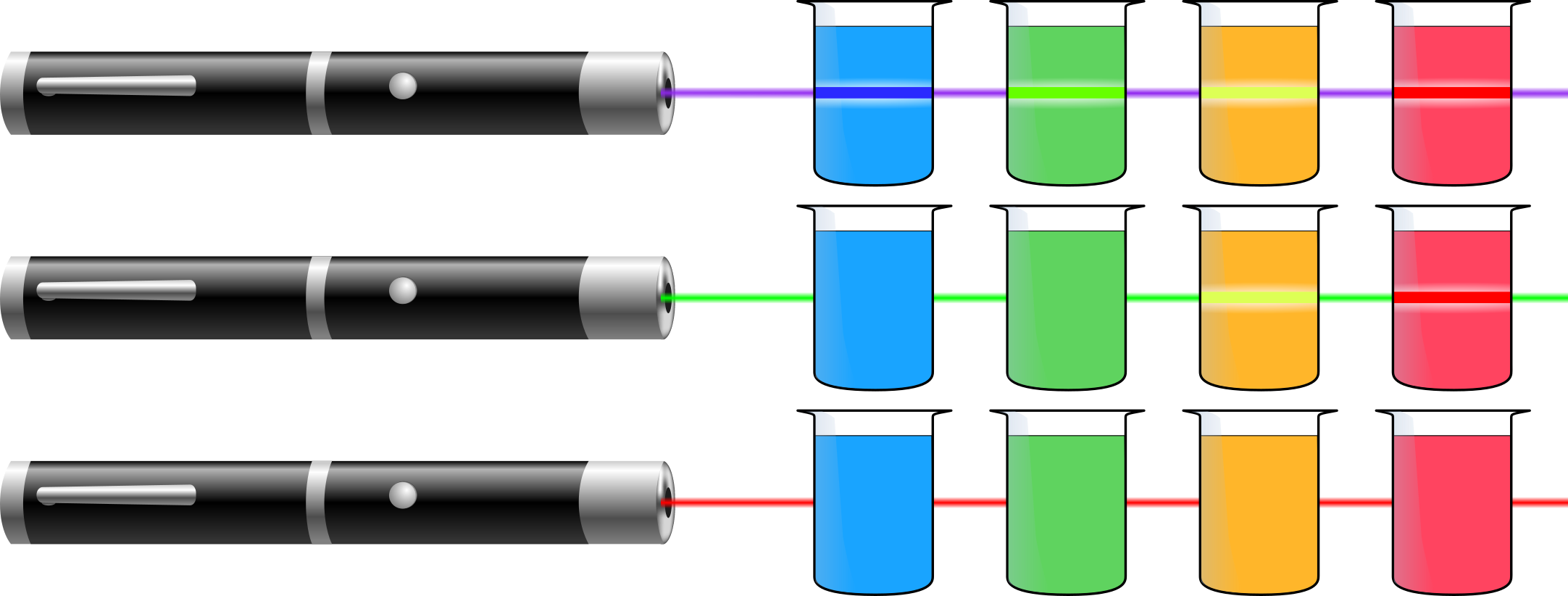
Abbildung: Beobachtete Fluoreszenz verschiedenfarbig fluoreszierender Lösungen nach Anregung mit Laserstrahlen verschiedener Wellenlängen.
Deutung:
Laser strahlen Licht bestimmter Wellenlängenbereiche aus, wobei die Länge der Wellen vom violetten zum roten Licht zunimmt (siehe Abbildung). Gleichzeitig sinkt jedoch der Energiegehalt der Photonen, so dass das violette Licht deutlich energiereicher ist als das rote. Unter UV-Licht fluoreszieren alle Lösungen in einer charakteristischen Farbe und emittieren somit Licht einer bestimmten Wellenlänge. Während der energiereichste Laser (violett) alle Lösungen zur Fluoreszenz anregt, ist der grüne Laserstrahl mittlerer Energie lediglich in der Lage, zwei Lösungen zum Leuchten zu bringen, während beim energieärmsten roten Laserstrahl keine der Lösungen fluoresziert. Da weder der grüne noch der rote Laser in der Lage sind, eine grüne bzw. rote Fluoreszenz hervorzurufen, lässt sich folgern, dass die Energie des eingestrahlten Lichts für die Emission von Fluoreszenzlicht größer sein muss, als das emittierte Licht.

Abbildung: Elektromagnetisches Spektrum des sichtbaren Lichts. Links an das Spektrum schließt sich der Bereich der ultravioletten Strahlung an (UV), rechts des Spektrums folgt der Bereich der Infrarotstrahlung (IR).
Anmerkungen zur Deutung des Experiments:
Im Gegensatz zu herkömmlichen „weißen“ Lichtquellen strahlen Laser annähernd monochromatisches Licht einer bestimmten Wellenlänge bzw. eines bestimmten Wellenlängenbereichs aus (violett ~ 405 nm, grün ~ 532 nm, rot ~ 650 nm). Entsprechend der antiproportionalen Beziehung zwischen der Wellenlänge des Lichts und der Energie eines Photons sinkt mit zunehmender Wellenlänge der Energiegehalt der Photonen, so dass das Licht des violetten Lasers energiereicher als das des roten Lasers ist. Für die Anregung verschiedener Fluorophore bedarf es bedingt durch ihre Molekülstruktur eines bestimmten Mindestenergiegehalts. Ähnlich wie bei Molekülen farbiger Substanzen wird nach Absorption einer bestimmten Energiemenge ein Teil der Energie strahlungslos über Translations- und Rotationsbewegungen abgegeben – wobei dieser Anteil gering ist – so dass das emittierte Licht einen geringen Energiegehalt und somit eine größere Wellenlänge als das absorbierte Licht besitzt, was auch als Stokes-Shift bezeichnet wird. Dieser auch als Rotverschiebung bezeichnete Effekt erklärt auch, warum z. B. die Energie eines grünen Laserstrahls nicht ausreicht, um einen im grünen Bereich fluoreszierenden Fluorophor zur Fluoreszenzemission anzuregen.
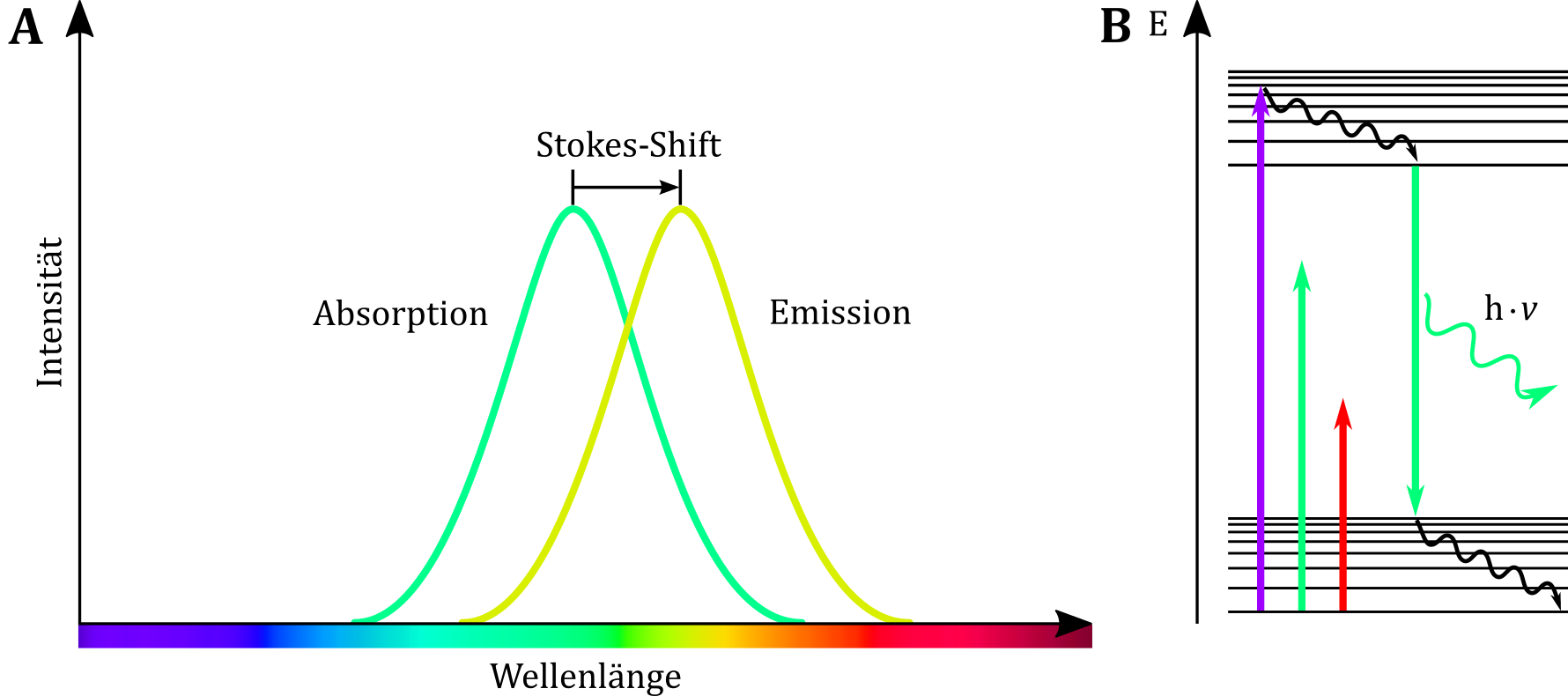
Abbildung: (A) Das Emissionsspektrum ist im Vergleich zum Absorptionsspektrum deutlich rotverschoben. (B) Aufgrund des Stokes-Shift reichen die Energien grüner bzw. roter Wellenlängenbereiche nicht aus, um eine grün fluoreszierende Substanz zur Fluoreszenz anzuregen.
Literatur:
- von Hoff, E. (2020). Entwicklung und Evaluation von Konzepten und Formaten zum Wissenstransfer von der Forschung in die Schule und Öffentlichkeit - Am Beispiel des SFB 803 (Dissertation). Georg-August-Universität Göttingen, Göttingen. Abrufbar unter http://hdl.handle.net/21.11130/00-1735-0000-0005-14C7-4.
Knicklichter – alternative Anregungsmöglichkeiten von Fluoreszenzfarbstoffen
Obwohl Knicklichter allseits bekannt sind, ist ihre Funktionsweise den meisten Menschen nicht bewusst.
Geräte und Chemikalien:
Knicklichter, UV-Lampe.
Versuchsdurchführung:
In einem abgedunkelten Raum werden ungeknickte Knicklichter mit UV-Licht beleuchtet. Anschließend wird ein Knicklicht ohne UV-Bestrahlung an einer einzelnen Stelle geknickt.
Beobachtung:
Auch ohne die Knicklichter zu knicken fluoreszieren sie unter UV-Beleuchtung in verschiedenen Farben. Dabei ist die Fluoreszenz nicht im gesamten Knicklicht zu beobachten, sondern auf ein zweites Röhrchen beschränkt, dass im Inneren des Knicklichts liegt (siehe Abbildung A). Beim Knicken bricht das innere Röhrchen sicht- und hörbar und an der Bruchstelle ist Fluoreszenzlicht wahrzunehmen, das sich langsam im Knicklicht verteilt.
Deutung:
Knicklichter bestehen aus einem biegsamen Kunststoffröhrchen mit einem darin eingelassenen Glasröhrchen (siehe Abbildung B), die eine Wasserstoffperoxidlösung räumlich von einer Oxalsäureesterlösung (z. B. Bis(2,4,6-trichlorphenyl)oxalat) trennen. Zudem enthält eines der Röhrchen einen Fluoreszenzfarbstoff, der je nach gewünschter Leuchtfarbe des Knicklichts variiert.

Abbildung: (A) Verschiedenfarbige Knicklichter im ungeknickten Zustand unter UV-Licht. (B) Schematische Darstellung der Funktion von Knicklichtern.
Beim Knicken des Knicklichts bricht das Glas und die beiden Flüssigkeiten mischen sich. Das Wasserstoffperoxid reagiert mit dem Oxalsäureester zu 1,2-Dioxetandion, das hochreaktiv ist und zu zwei Kohlenstoffdioxidmolekülen zerfällt (siehe Abbildung 66). Dabei liegt eines der Moleküle in einem angeregten Singulettzustand vor, dass seine Energie auf die in der Mischung vorhandenen Fluoreszenzfarbstoffe übertragen kann. Bei der Abregung der Farbstoffmoleküle wird diese Energie wiederum in Form von Photonen abgegeben, so dass ein Leuchten zu beobachten ist. Der Fluoreszenzfarbstoff liegt nach der Reaktion unverändert vor, so dass er, auch nachdem das Knicklicht nicht mehr leuchtet, von UV-Licht zur Fluoreszenz angeregt werden kann.
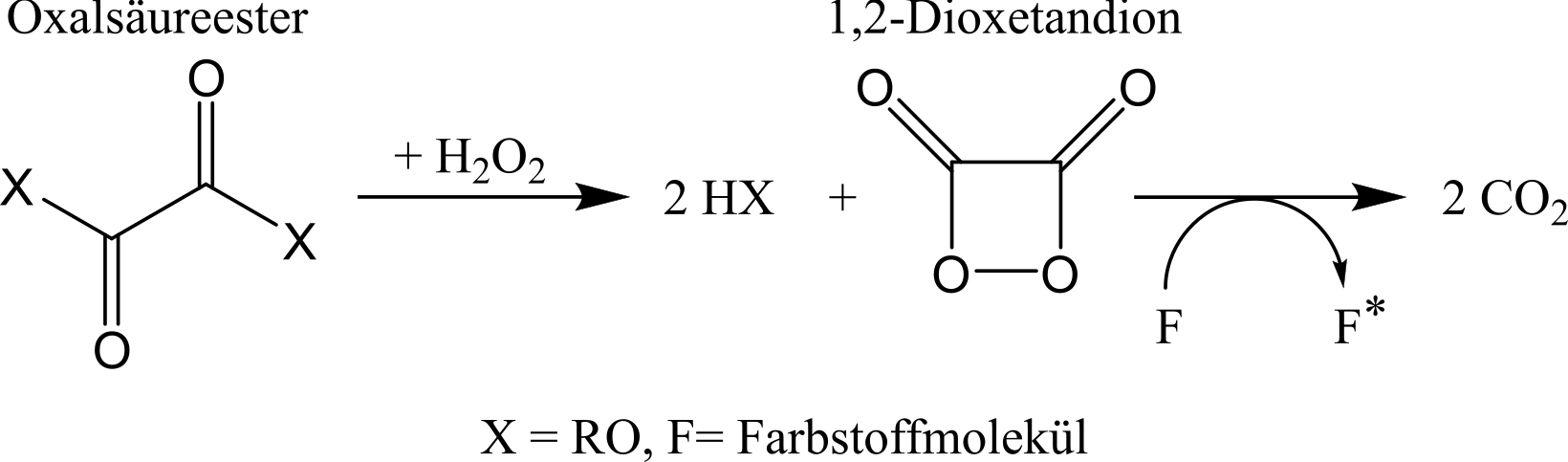
Abbildung: Allgemeiner Reaktionsmechanismus für die Reaktion eines Oxalsäureesters mit Wasserstoffperoxid in einem Knicklicht.
Anmerkungen zur Deutung des Experiments:
In den bisherigen Experimenten erfolgte eine Anregung von Fluoreszenzfarbstoffen immer mithilfe von energiereichem Licht. Es bestehen jedoch weitere Möglichkeiten, dem System die benötigte Energie zuzuführen. Wird ein Molekül infolge einer chemischen Reaktion zur Emission eines Photons angeregt, so spricht man von Chemolumineszenz. Dabei gibt entweder eines der Reaktionsprodukte, das sich in einem angeregten Zustand befindet, die Energie selbst unter Emission eines Photons ab, oder überträgt sie – wie in diesem Fall – auf einen an der Reaktion unbeteiligten Fluoreszenzfarbstoff (Wöhrle & Tausch, 1998).
Die Behandlung der Chemilumineszenz bietet sich in vielerlei Hinsicht an. Zum einen kann das Phänomen der Fluoreszenz noch einmal an einem für die SuS bekannten Alltagsgegenstand betrachtet werden. Zudem kann in diesem Zuge auch auf die Relevanz der Chemielumineszenz für biolumineszente Prozesse in der Natur, z. B. bei Tieren und Einzellern, verwiesen werden. Die Verwendung von Knicklichtern bietet sich zusätzlich auch zur Ausbildung eines situationalen Interesses an. Zudem ist die strahlungslose Energieübertragung von einem Molekül auf ein anderes auch von elementarer Bedeutung für einige der nachfolgenden Experimente.
Literatur:
- Salter, C., Range, K., & Salter, G. (1999). Laser-Induced Fluorescence of Lightsticks. Journal of Chemical Education, 76(1), 84. DOI: 10.1021/ed076p84.
- Wöhrle, D., Tausch, M. W., & Stohrer, W.‑D. (1998). Photochemie: Konzepte, Methoden, Experimente (1st ed.). Weinheim: Wiley-VCH.
- von Hoff, E. (2020). Entwicklung und Evaluation von Konzepten und Formaten zum Wissenstransfer von der Forschung in die Schule und Öffentlichkeit - Am Beispiel des SFB 803 (Dissertation). Georg-August-Universität Göttingen, Göttingen. Abrufbar unter http://hdl.handle.net/21.11130/00-1735-0000-0005-14C7-4.
Sensitivität von Fluoreszenzfarbstoffen
Insbesondere bei Betrachtung verschiedener Forschungsmethoden wie der Fluoreszenzmikroskopie und –spektroskopie, bspw. in Schülerlaboren, eignet sich dieser Versuch, um die Sensitivität von Fluoreszenzfarbstoffen zu verdeutlichen.
Geräte und Chemikalien:
6 Schnappdeckelgläser, fluoreszierende Lösung (z. B. Textmarkerlösung), UV-Lampe, Laserpointer (violett oder grün)
Versuchsdurchführung:
Mithilfe einer fluoreszierenden Lösung wird eine Verdünnungsreihe erstellt, indem 1 mL der farbigen Lösung mit 10 mL Wasser versetzt wird. Wiederum 1 mL dieser neuen Lösung wird mit weiteren 10 mL Wasser versetzt. Auf diese Weise werden 5-6 verdünnte Lösungen erstellt und alle nacheinander mit einem Laserstrahl durchleuchtet.
Beobachtung:
Die farbigen Textmarkerlösungen fluoreszieren unter UV-Licht. Die Lösungen der Verdünnungsreihe erscheinen ab der dritten Verdünnungsstufe farblos. Beim Durchstrahlen der Lösungen mit einem Laserpointer ist der Strahlengang als Fluoreszenzlicht wahrnehmbar. Die Fluoreszenz liegt auch bei Farblosigkeit der Lösungen noch vor, verliert aber mit zunehmender Verdünnung an Intensität (siehe Abbildung).

Abbildung: Fluoreszenz in vormals farbigen Textmarkerlösungen nach mehrmaliger Verdünnung.
Deutung:
Die Farbintensität einer Lösung hängt u. a. von der Konzentration der Farbstoffmoleküle ab, weshalb eine Verdünnung schnell zur makroskopischen Entfärbung der Lösung führt. Fluoreszenzfarbstoffe besitzen eine hohe Sensitivität, weshalb eine Fluoreszenz auch noch bei starker Verdünnung wahrnehmbar ist.
Anmerkungen zur Deutung des Experiments:
Die Fluoreszenzintensität eines Fluoreszenzfarbstoffs hängt von seiner jeweiligen Quantenausbeute ab. Diese beschreibt das Verhältnis zwischen der Anzahl absorbierter Photonen und der daraus resultierenden Emissionsintensität und kann beispielsweise durch strahlungslose Übertragung der Energie auf ein anderes Molekül verringert werden (vgl. Experiment Quenching-Effekt) (Schmitz & Diesel, 2018). Allgemein unterliegt die wahrgenommene Fluoreszenzintensität einer Lösung, ähnlich wie die Farbintensität, dem Verdünnungseffekt, jedoch ist auch noch bei sehr geringen Fluorophorkonzentrationen, insbesondere bei einer hohen Quantenausbeute, eine Fluoreszenz wahrnehmbar. Diese hohe Sensitivität wird beispielsweise in der Fluoreszenzspektroskopie ausgenutzt und ermöglicht es gerade bei den neueren fluoreszenzmikroskopischen Verfahren, auch bei Auflösungen im Bereich weniger Nanometer Strukturen über die Fluoreszenz einiger weniger Moleküle weiter aufklären zu können.
Literatur:
- von Hoff, E. (2020). Entwicklung und Evaluation von Konzepten und Formaten zum Wissenstransfer von der Forschung in die Schule und Öffentlichkeit - Am Beispiel des SFB 803 (Dissertation). Georg-August-Universität Göttingen, Göttingen. Abrufbar unter http://hdl.handle.net/21.11130/00-1735-0000-0005-14C7-4.
- Schmitz, S., & Desel, C. (2018). Der Experimentator Zellbiologie. Berlin, Heidelberg: Springer Berlin Heidelberg.
Quenching-Effekt
Der Quenching-Effekt spielt in der Fluoreszenzmikroskopie und - skeptroskopie eine wichtige Rolle, weshalb es sich in Verbindung mit diesem Experiment lohnt, den Effekt zunächst experimentell anhand dieses Versuchs zu erarbeiten.
Geräte und Chemikalien:
2 Schnappdeckelgläser, Pasteurpipette, Spatel, UV-Lampe, chininhaltige Lösung (z. B. Tonic Water), Natriumchlorid.
Versuchsdurchführung:
Wenige Milliliter einer chininhaltigen Lösung werden in zwei Schnappdeckelgläser gefüllt. Unter Bestrahlung mit UV-Licht wird zu einer der Lösungen eine Spatelspitze Natriumchlorid hinzugegeben.
Beobachtung:
Beide Lösungen fluoreszieren zunächst. Nach Zugabe des Natriumchlorids zu einer der Lösungen ist für diese keine Fluoreszenz mehr zu beobachten (siehe Abbildung).

Abbildung: Chininhaltige Lösung unter UV-Licht vor (A) und nach Zugabe von Natriumchlorid (B).
Deutung:
Zusätzliche Teilchen in Lösung können für eine Löschung (engl.: Quenching) der Fluoreszenz bzw. zu einer Minderung ihrer Intensität führen. In diesem Experiment dienen die Chloridionen als Stoßpartner, auf die die Energie des angeregten Fluorophors übertragen wird. Dieser kehrt anschließend durch strahlungslose Desaktivierung in den Grundzustand zurück.
Anmerkungen zur Deutung:
Bitte beachten Sie die Anmerkungen zur Deutung der Experimente im separten Beitrag.
Litertaur:
- Gutow, J. H. (2005). Halide (Cl-) Quenching of Quinine Sulfate Fluorescence: A Time-Resolved Fluorescence Experiment for Physical Chemistry. Journal of Chemical Education, 82(2), 302. DOI: 10.1021/ed082p302.
- von Hoff, E. (2020). Entwicklung und Evaluation von Konzepten und Formaten zum Wissenstransfer von der Forschung in die Schule und Öffentlichkeit - Am Beispiel des SFB 803 (Dissertation). Georg-August-Universität Göttingen, Göttingen. Abrufbar unter http://hdl.handle.net/21.11130/00-1735-0000-0005-14C7-4.
Seite 1 von 2

