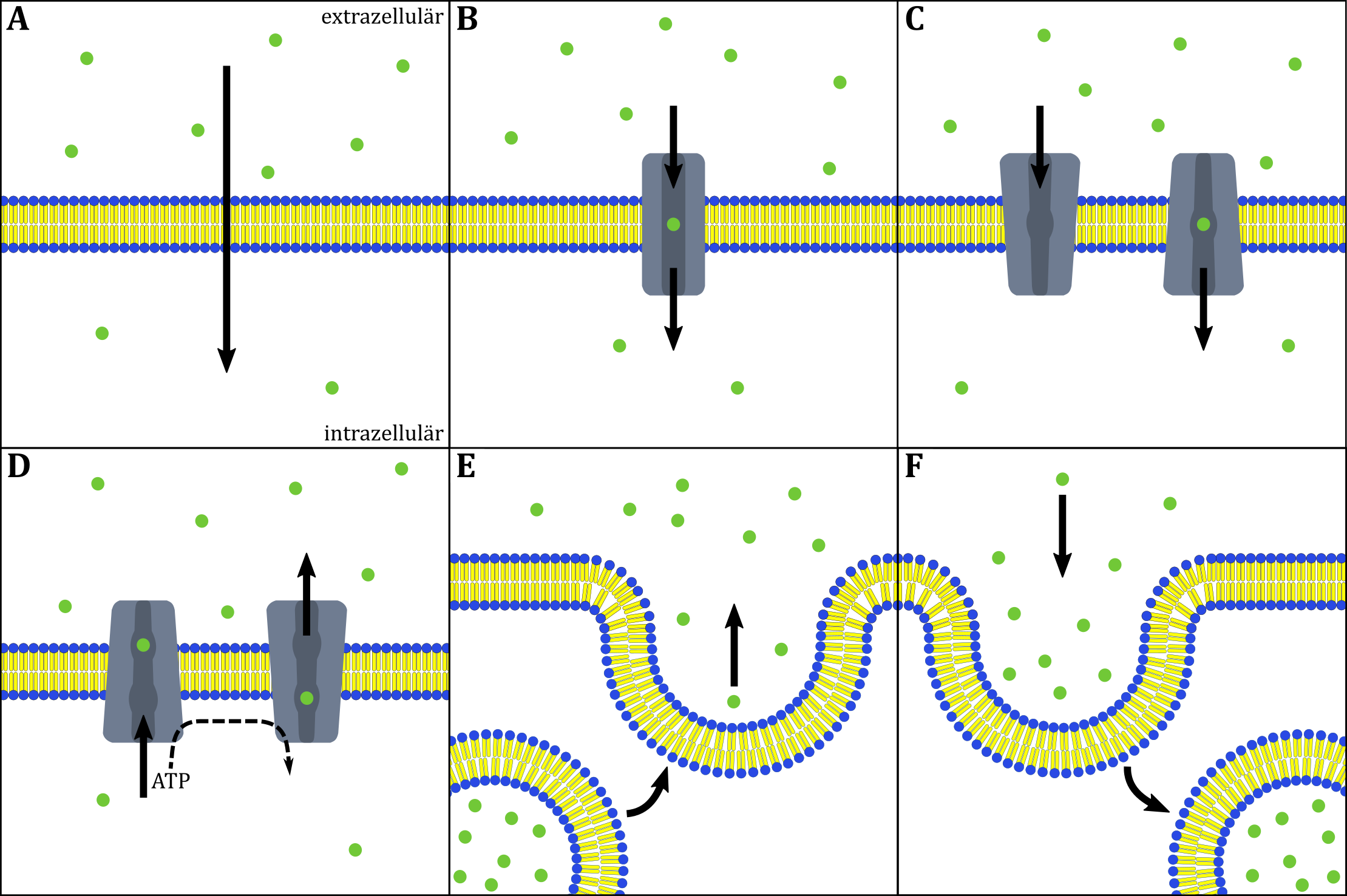
Die Abbildung zeigt eine schematische Darstellung verschiedener Membrantransportarten. (A) einfache Diffusion, (B) schnelle Diffusion durch ein Kanalprotein, (C) carriervermittelter passiver Transport, (D) carriervermittelter aktiver Transport, (E) Exocytose, (F) Endocytose.
In diesem Themenfeld finden Sie drei Experimente zu der Selbstorganisation amphiphiler Moleküle:
Bitte beachten Sie bei den beiden Experimenten zur Exocytose die Anmerkungen zur Deutung der Experimente.
Erleichterte Diffusion großer Moleküle
Mithilfe dieses Experiments kann die Diffusion unterschiedlich großer Moleküle im wässrigen Medium anhand ihrer Fluoreszenzeigenschaften untersucht werden. Aufgrund der verwendeten Chemikalien bietet sich eine Anwendung vor allem im Schülerlabor an.
Geräte und Chemikalien:
Becherglas (250 mL), 2 Schnappdeckelgläser (30 mL), Spatel, Dialyseschlauch (14 kD, 10 cm), Frischhalteklammern oder Gummibänder, Laserpointer (grün, violett), demin. Wasser, dextrangebundenes Texas Red (70 kD), Pyranin (GHS07).
Versuchsdurchführung:
In zwei Schnappdeckelgläsern werden eine Spatelspitze Texas Red und eine Spatelspitze Pyranin jeweils in 10 mL Wasser gelöst. Ein Dialyseschlauch wird von innen und außen gründlich mit Wasser gespült, eine Öffnung mit einer Frischhalteklammer verschlossen und der Schlauch so in ein mit Wasser gefülltes Becherglas gelegt, dass das obere Ende herausragt. Der Schlauch wird jeweils mit ca. 10 mL beider Lösungen befüllt und mit einer zweiten Klammer verschlossen. Anschließend werden die beiden übrigen Lösungen in den Schnappdeckelgläsern sowie der Inhalt des Becherglases und des Dialyseschlauches mittels eines violetten und eines grünen Laserpointers untersucht.
Beobachtung:
Die beiden Lösungen in den Schnappdeckelgläsern können mithilfe des violetten Lasers im Falle von Pyraninlösung zu grüner und im Falle von Texas Red-Lösung zu roter Fluoreszenzemission angeregt werden (siehe Abbildung 41A). Der grüne Laser regt hingegen lediglich die Texas Red-Lösung zur Fluoreszenz an. Bei Bestrahlung des Inhalts des Becherglases mit dem violetten Laser ist zunehmend auch eine grüne Fluoreszenz außerhalb des Dialyseschlauchs zu beobachten. Eine durch den grünen Laser angeregte rote Fluoreszenz ist hingegen lediglich innerhalb des Dialyseschlauchs wahrnehmbar.

Abbildung: (A) Schematische Darstellung der Anregung zur Fluoreszenz auf makroskopischer Ebene. (B, C) Submikroskopische Darstellung der Diffusion der Pyraninmoleküle durch den Dialyseschlauch.
Deutung:
Der Dialyseschlauch weist eine Porengröße von 14 kD auf. Er fungiert somit als semipermeable Membran, durch die lediglich Moleküle durchtreten können, die in ihrem Durchmesser kleiner als die Porengröße sind. Mithilfe des UV-Lichts kann der Durchtritt der Pyraninmoleküle, die sich in ihrer Größe deutlich von Ionen oder kleinen Molekülen wie Wasser unterscheiden, entlang des Konzentrationsgefälles in das wässrige Außenmedium nachgewiesen werden. Die Dextran-gebundenen Texas Red-Moleküle sind hingegen mit einer Größe von 70 kD zu groß, um durch die Poren durchzutreten (vgl. die Strukturformeln der Moleküle in Abbildung 42). Entsprechend verbleiben sie im Dialyseschlauch, was anhand der laserinduzierten roten Fluoreszenz nachgewiesen werden kann.

Abbildung: Strukturformeln der Moleküle von dextrangebundenem Texas Red sowie Pyranin. Die Glucoseeinheiten können α-1,4- oder α-1,6-glycosidisch verbunden sein, so dass verzweigte Dextrannetzwerke entstehen.
Anmerkungen zur Deutung des Experiments:
Je größer, polarer und geladener ein Molekül ist, desto langsamer verläuft die einfache Diffusion durch die Lipiddoppelschicht. Transportproteine die Kanäle bilden ermöglichen es auch solchen Teilchen, mit dem Konzentrationsgefälle schnell von einer Seite der Membran zur anderen zu diffundieren. Dabei bilden die Kanäle nur schwache Wechselwirkungen mit den zu transportierenden Teilchen aus. Eine Vielzahl der Kanäle ist dabei selektiv auf bestimmte Moleküle oder Molekülsorten spezialisiert. Ähnlich wie in Experiment bestimmt u. a. die Porengröße, welche Moleküle durch den Kanal durchtreten können. Es existieren jedoch auch zahlreiche Kanäle, wie bspw. die auf Wassermoleküle spezialisierten Aquaporine, die nicht nur größenselektiv sind, sondern auch deutlich kleinere geladene Teilchen wie Protonen nicht passieren lassen.
Literatur:
- von Hoff, E. (2020). Entwicklung und Evaluation von Konzepten und Formaten zum Wissenstransfer von der Forschung in die Schule und Öffentlichkeit - Am Beispiel des SFB 803 (Dissertation). Georg-August-Universität Göttingen, Göttingen. Abrufbar unter http://hdl.handle.net/21.11130/00-1735-0000-0005-14C7-4.
Exocytose
Als Modellexperiment zur Darstellung der Vesikelfusion am synaptischen Spalt kann dieser Versuch sowohl im Unterricht als auch auf Bildungsmessen eingesetzt werden.
Geräte und Chemikalien:
4 Bechergläser (2x 250 mL, 500 mL und 1 L), großes Reagenzglas (∅ 20-30 mm), Stativmaterial, Einwegspritze (10 mL), 2 Vollpipetten (20 mL und 100 mL), Glasrührstab, Spatel, Wasser, Spülmittel, Pyranin (GHS07), Glucose, Methylenblau (GHS07).
Versuchsdurchführung:
Zunächst werden die folgenden Lösungen unter vorsichtigem Rühren angesetzt: (1) in 1 L Wasser wird etwa 1 g Spülmittel gelöst, (2) 100 mL dieser Spülmittellösung werden in ein 250 mL Becherglas überführt und mit einer Spatelspitze Methylenblau sowie 6 g Glucose versetzt, (3) in einem 500 mL Becherglas werden 32 g Glucose in 400 mL der Lösung 1 gelöst, (4) eine Hälfte der Lösung 3 wird mit einer Spatelspitze Pyranin versetzt.
Ein großes Reagenzglas wird in ein Stativ eingespannt und anschließend die Lösungen 1 bis 3 übereinandergeschichtet. Dazu werden zunächst ca. 40 mL von Lösung 1 in das Reagenzglas gefüllt und diese vorsichtig und langsam mit 10 mL der Lösung 2 unterschichtet. Anschließend werden beide Lösungen mit etwa 40 mL der Lösung 3 unterschichtet. Lösung 4 wird mit einer Spritze aufgezogen. Die Spritze wird ca. 1 cm über der Oberfläche der Lösungen im Reagenzglas positioniert und es werden sukzessive einzelne Tropfen in das Reagenzglas getropft. Die Fallhöhe der Tropfen wird so lange variiert, bis sich Antiblasen (invertierte Seifenblasen) in der Lösung bilden. Das Reagenzglas kann zur besseren Visualisierung zudem mit einer UV-Lampe bestrahlt werden.
Beobachtung:
Die Lösungen 1 bis 3 liegen im Reagenzglas als drei getrennte Phasen vor. Beim Zutropfen der Lösung 4 (Pyraninlösung) bilden sich kleine mit Pyraninlösung gefüllte Blasen, die durch die oberste Schicht an die Phasengrenze zwischen der mittleren und der unteren Schicht sinken. Dort platzen die Blasen nach einiger Zeit und geben ihren Inhalt an die unterste Phase ab. Pyraninlösung die keine Blasen bildet verbleibt in der obersten Schicht und färbt diese gelb (Abbildung A – C).
Deutung:
Beim Zutropfen einer Glucose-Tensidlösung mit hoher Dichte orientieren sich die hydrophoben Bereiche der Tensidmoleküle in Richtung der Luft. Sobald der Tensidtropfen auf die Tensidschicht des Becherglases trifft wird ein dünner Luftfilm (in Abbildung F hellblau gezeigt) durch eine weitere Tensidschicht eingeschlossen. Dabei bildet sich eine doppelte Tensidschicht, die analog einer Lipiddoppelschicht aufgebaut ist (siehe Abbildung 46F). Aufgrund der hohen Dichte der eingeschlossenen farbigen Tensidlösung sinkt diese sogenannte Antiblase (Suhr & Schlichting, 2011), bis an die Grenzfläche der untersten Schicht, da die Dichte in der Blase etwa der Dichte der untersten Phase entspricht. An dieser Grenzfläche platzt die Antiblase und der Farbstoff wird in die untere Phase abgegeben.
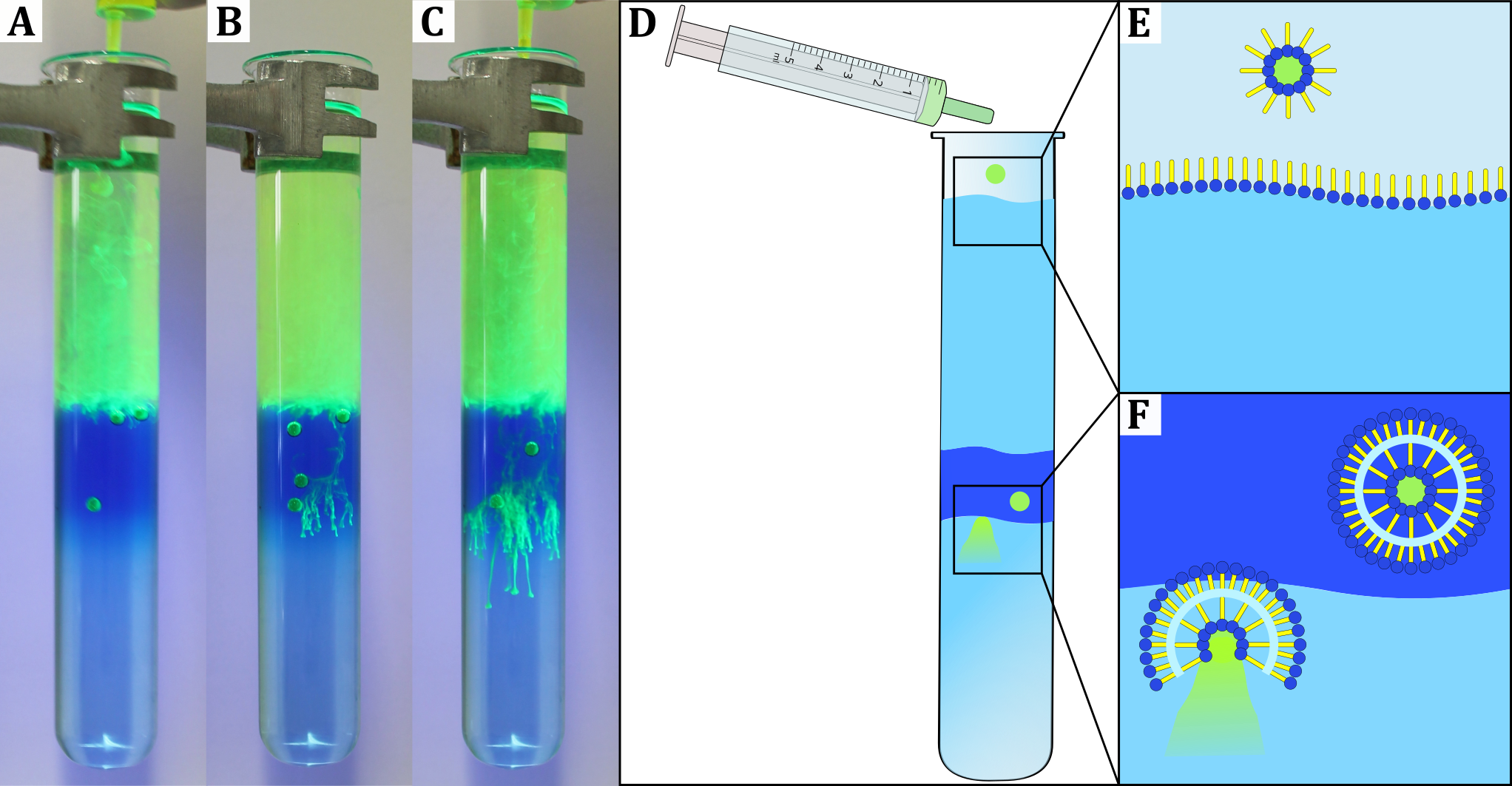
Abbildung: (A-C) Eine farbstoffgefüllte Antiblase sinkt durch die zwei oberen Lösungen mit geringerer Dichte, verbleibt kurz an der Grenzschicht zur untersten Lösung und gibt beim Platzen den eingeschlossen Farbstoff in die unterste Phase ab. (D-F) Schematische Darstellung des Modellexperiments.
Anmerkungen zur Deutung:
Bitte beachten Sie die Anmerkungen zur Deutung der Experimente im separten Beitrag.
Litertaur:
- von Hoff, E. (2020). Entwicklung und Evaluation von Konzepten und Formaten zum Wissenstransfer von der Forschung in die Schule und Öffentlichkeit - Am Beispiel des SFB 803 (Dissertation). Georg-August-Universität Göttingen, Göttingen. Abrufbar unter http://hdl.handle.net/21.11130/00-1735-0000-0005-14C7-4.
- Suhr, W., & Schlichting, H. J. (2011). Antibubbles - Experimentelle Zugänge. In V. Nordmeier & H. Grötzebauch (Chairs), PhyDid B - Didaktik der Physik - Beiträge zur DPG-Frühjahrstagung, Münster.
Gehinderte Exocytose
Analog zum vorherigen Experiment stellt dieser Versuch ein Modell für die gehinderte Exocytose dar und kann beispielsweise im Kontext des Wirkmechanismus von Botulinumtoxinen eingesetzt werden.
Geräte und Chemikalien:
4 Bechergläser (100 mL, 250 mL, 500 mL und 1 L), großes Reagenzglas (∅ 20-30 mm), Stativmaterial, Eppendorf-Pipettenspitze (5 mL), 2 Vollpipetten (20 mL und 100 mL), Glasrührstab, Spatel, Magnetrührer mit Rührfisch, Waage, Schere, Pasteurpipette, Wasser, Spülmittel, Pyranin (GHS07), Glucose, Methylenblau (GHS07), Natriumalginat, Calciumchlorid (GHS07).
Versuchsdurchführung:
Ähnlich wie in Versuch 4.3a werden 4 Lösungen angesetzt: (1) in 1 L Wasser werden 15 g Calciumchlorid mithilfe eines Magnetrührers und im Anschluss zudem vorsichtig etwa 1 g Spülmittel mittels eines Glasrührstabs gelöst, (2) 100 mL dieser Lösung werden in ein 250 mL Becherglas überführt und mit einer Spatelspitze Methylenblau sowie 2 g Glucose versetzt, (3) in einem 500 mL Becherglas werden 32 g Glucose in 400 mL der Lösung 1 gelöst, (4) in einem 100 mL Becherglas werden 0,5 g Natriumalginat in 40 mL Wasser mithilfe eines Magnetrührers gelöst. Anschließend wird die Lösung mit einer Spatelspitze Pyranin versetzt.
Ein großes Reagenzglas wird in ein Stativ eingespannt und anschließend die Lösungen 1 bis 3 übereinandergeschichtet. Dazu werden zunächst ca. 40 mL von Lösung 1 in das Reagenzglas gefüllt und diese vorsichtig und langsam mit 10 mL der Lösung 2 unterschichtet. Anschließend werden beide Lösungen mit etwa 40 mL der Lösung 3 unterschichtet. Mit einer Schere wird die Öffnung der Pipettenspitze etwas vergrößert und diese etwa 4 cm über dem Duranglas eingespannt. Die Pipettenspitze wird mit wenigen Millilitern der Lösung 4 befüllt, so dass die Lösung in das Reagenzglas tropft und kleine Kugeln entstehen. Sollten sich stattdessen lange Fäden bilden, muss die Fallhöhe variiert werden.
Beobachtung:
Die Lösungen 1 bis 3 liegen im Reagenzglas als drei getrennte Phasen vor. Beim Zutropfen der Lösung 4 (Alginatlösung) bilden sich kleine mit Pyraninfarbstoff gefüllte Kugeln, die durch die oberste Schicht an die Phasengrenze zwischen der mittleren und der unteren Schicht sinken. Dort verweilen die Kugeln und lediglich die oberste Schicht weist eine leichte gelbe Färbung auf (Abbildung A – C).

Abbildung: (A-C) Eine farbstoffgefüllte Natriumalginatblase sinkt durch die zwei oberen Lösungen mit geringerer Dichte und verbleibt auch nach längerer Zeit an der Grenzschicht zur untersten Lösung derselben Dichte. (D) Strukturformel von Alginat, (E) schematische Darstellung des Alginatkomplexes (Ducci, 2016).
Deutung:
Natriumalginat ist ein kettenförmiges Polysaccharid, das aus den Monomeren α-L-Guluronsäure und β-D-Mannuronsäure besteht. Während verknüpfte β-D-Mannuronsäuremoleküle geradlinige Ketten ausbilden, bilden α-L-Guluronsäuremoleküle geknickte Ketten aus (siehe Abbildung 47D). Beim Zutropfen der Algniatlösung zu einer Calciumchloridlösung lagern sich verschiedene Kettenabschnitte mit mehreren Guluronsäuremolekülen zusammen, wobei in den entstehenden Hohlräumen Calciumionen in einem Chelatkomplex gebunden werden (siehe Abbildung E) (Emmerichs, 2004). Um die Tropfen bildet sich so eine Gelschicht, in die die übrige Alginatlösung eingebettet ist.
Die in diesem Fall auch mit dem Farbstoff Pyranin gefüllten Alginatbällchen besitzen eine höhere Dichte als die Lösungen 1 und 2, weshalb sie an die Grenzfläche der zweiten und dritten Lösung sinken und dort verweilen. Die membranartige Gelschicht ist dabei nicht gänzlich undurchlässig für den Farbstoff, der aufgrund seiner geringeren Dichte aus den Alginatbällchen heraus in die erste Lösung diffundiert.
Anmerkungen zur Deutung der Experimente:
Bitte beachten Sie die Anmerkungen zur Deutung der Experimente im separten Beitrag.
Litertaur:
- von Hoff, E. (2020). Entwicklung und Evaluation von Konzepten und Formaten zum Wissenstransfer von der Forschung in die Schule und Öffentlichkeit - Am Beispiel des SFB 803 (Dissertation). Georg-August-Universität Göttingen, Göttingen. Abrufbar unter http://hdl.handle.net/21.11130/00-1735-0000-0005-14C7-4.
- Ducci, M. (2016). „Jetzt geht’s rund“ - Redoxreaktionen in Alginatbällchen. CHEMKON, 23(1), 14–18. DOI: 10.1002/ckon.201610262.
- Emmerichs, N. (2004). Untersuchung der Wechselwirkungen von Mangan- und Calciumionen mit Alginat von Algen und von verschiedenen mucoiden Stämmen des Bakteriums Pseudomonas aeruginosa (Dissertation). Universität Duisburg-Essen, Duisburg. Abrufbar unter http://purl.oclc.org/NET/duett-08312004-103654.
Anmerkungen zur Deutung der Experimente
Folgende Anmerkungen sollten bei der Auswertung der Versuche Exocytose und Gehinderte Exocytose beachtet werden.
Bei der Erregungsübertragung im Nervensystem spielt insbesondere der Transportmechanismus der Exocytose eine wichtige Rolle. Nervenzellen bestehen aus einem System weitverzweigter Dendriten, von denen aus Aktionspotenziale über das Axon zu den präsynaptischen Endigungen geleitet werden. Diese Endigungen bilden wiederum mit den Dendriten anderer Nervenzellen sogenannte Synapsen, über die die Potentiale von einer Nervenzelle zur nächsten übertragen werden.
An chemischen Synapsen erfolgt die Weiterleitung solcher Signale über die Ausschüttung von Neurotransmittern, wie z. B. Acetylcholin, die in kleinen Membranbläschen, den Vesikeln, aufbewahrt sind. Erreicht ein Aktionspotential eine präsynaptische Endigung, werden spannungsabhängige Calciumkanäle geöffnet, so dass sich die Calciumionenkonzentration im Inneren der Endigung erhöht. Diese erhöhte Konzentration fördert die Bildung sogenannter SNARE-Komplexe – Proteinkomplexe zwischen Membranproteinen der präsynaptischen Endigung und der neurotransmittergefüllten Vesikel – die zu einer Fusion der beiden Membranen und der Ausschüttung der Neurotransmitter führen. Diese Neurotransmitter gelangen über den synaptischen Spalt zur postsynaptischen Region der Dendriten weiterer Nervenzellen, wo sie als Rezeptoren für Ionenkanäle dienen, deren Öffnung ein Aktionspotential in der nächsten Nervenzelle auslöst (siehe Abbildung B).
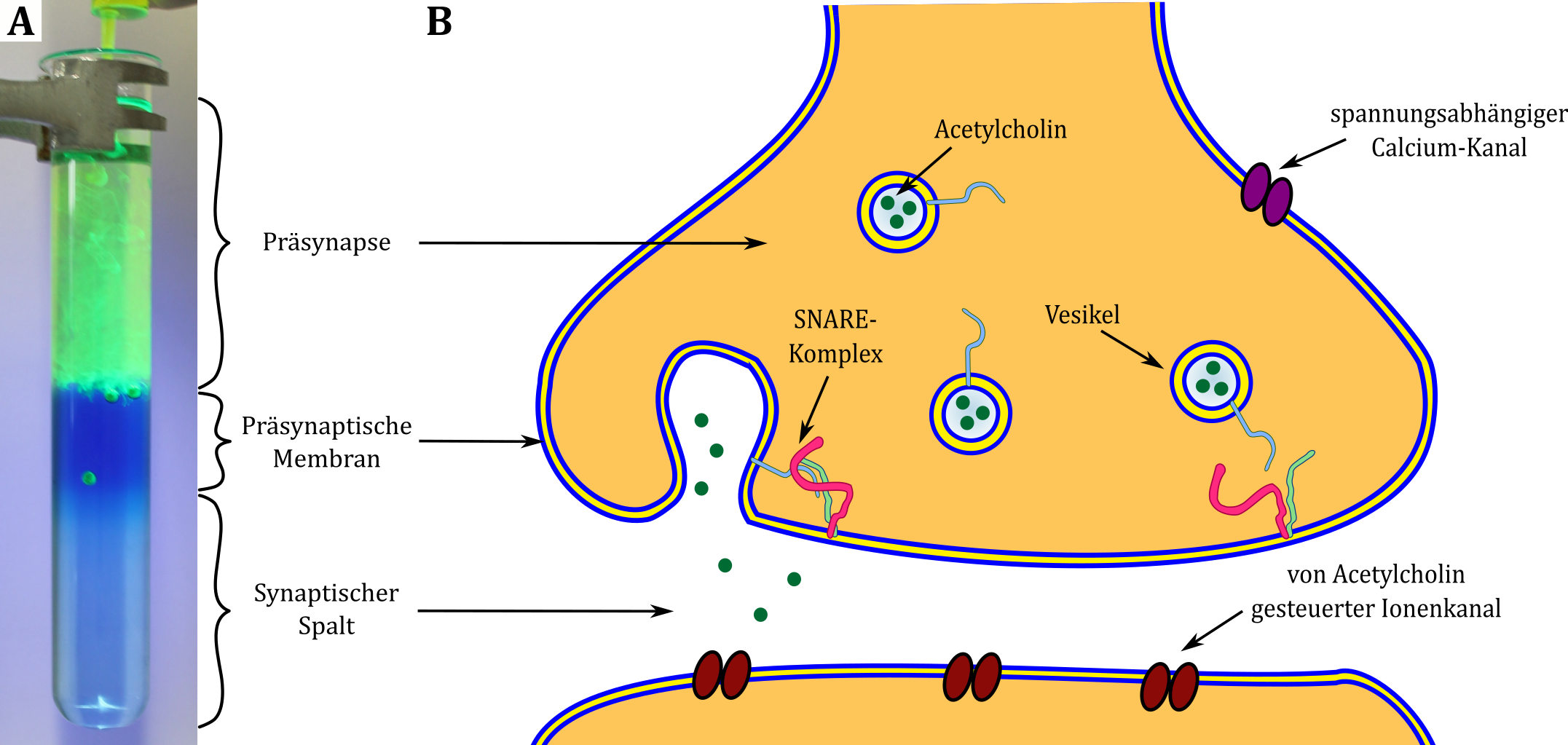
Abbildung: Vergleich des Modellexperiments zur Exocytose (A) mit der schematische Darstellung der Ausschüttung von Neurotransmittern durch Exocytose am synaptischen Spalt (B).
Das Experiment Exocytose stellt ein Modell für die Ausschüttung von Neurotransmittern in den synaptischen Spalt dar. Dabei stellen die verschiedenen Phasen von oben nach unten gesehen die Präsynapse, die präsynaptische Membran und den synaptischen Spalt dar. Die Antiblasen dienen als Modelle für Vesikel, die mit einer gefärbten Lösung (= Neurotransmitter) gefüllt sind. Nur wenn die Antiblasen sich beim Platzen an der unteren Grenze der blau angefärbten Phase befinden, geben sie ihren Inhalt in die unterste Phase, also in den synaptischen Spalt ab. Lediglich die Anlagerung an die Membran der präsynaptischen Endigung ermöglicht also eine Ausschüttung des Neurotransmitters in den synaptischen Spalt.
In der aktuellen Forschung, u. a. auch des SFB 803, ist insbesondere die Aufschlüsselung verschiedener Prozesse der Membranfusion, die durch SNARE-Proteine gesteuert werden, von großem Interesse. Bereits bekannt ist bspw., dass die Proteine Angriffspunkte verschiedener Toxine wie Tetanus- und Botulinumtoxin sind (Sutton et al., 1998). Letzteres wird umgangssprachlich auch als Botox bezeichnet. Insbesondere vor dem Hintergrund, dass SuS ein großes Interesse an medizinischen Themen zeigen (Holstermann & Bögeholz, 2007; Milsch et al., 2018) bietet sich eine Betrachtung der Wirkweisen von Botox auf die SNARE-Proteine sowie damit einhergehend den Prozess der Exocytose an, um das aktuelle Forschungsinteresse bezüglich der SNAREs zu verdeutlichen. Das Experiment Gehinderte Exocytose bietet durch die Verwendung von farbstoffgefüllten Alginatbällchen zudem zusätzlich die Möglichkeit, das Modellexperiment zur Exocytose in Bezug auf die Wirkung von Botox zu erweitern.
Literatur:
- von Hoff, E. (2020). Entwicklung und Evaluation von Konzepten und Formaten zum Wissenstransfer von der Forschung in die Schule und Öffentlichkeit - Am Beispiel des SFB 803 (Dissertation). Georg-August-Universität Göttingen, Göttingen. Abrufbar unter http://hdl.handle.net/21.11130/00-1735-0000-0005-14C7-4.
- Sutton, R. B., Fasshauer, D., Jahn, R., & Brunger, A. T. (1998). Crystal structure of a SNARE complex involved in synaptic exocytosis at 2.4 A resolution. Nature, 395(6700), 347–353. DOI: 10.1038/26412.
- Holstermann, N., & Bögeholz, S. (2007). Interesse von Jungen und Mädchen an naturwissenschaftlichen Themen am Ende der Sekundarstufe I. Zeitschrift Für Didaktik Der Naturwissenschaften, 13, 71–86.
- Milsch, N., von Hoff, E., Mey, I., & Waitz, T. (2018). Zum Interesse von Jugendlichen an Science Outreach Projekten. In C. Maurer (Ed.), Qualitätsvoller Chemie- und Physikunterricht - normative und empirische Dimensionen: Gesellschaft für Didaktik der Chemie und Physik. Jahrestagung in Regensburg 2017 (pp. 625–627). Regensburg: Universität Regensburg.

