In diesem Themenfeld finden Sie drei Experimente zu Untersuchungsmethoden in der Membranforschung:
- Lipidextraktion aus Eigelb – Isolation von Lecithin
- Herstellung von Lipidfilmen durch Quellen
- Fluoreszenzmarkierte Fusion von Seifenblasen
Bitte beachten Sie bei den ersten beiden Experimenten die Anmerkungen zur Deutung der Experimente.
Lipidextraktion aus Eigelb – Isolation von Lecithin
Dieser Versuch ermöglicht die Extraktion von Lipiden aus Eigelb, die zur Herstellung von Vesikeln in dem nachfolgenden Experiment Herstellung von Lipidfilmen durch Quellen verwendet werden können. Aufgrund des hohen Zeitaufwands eignet sich die Extraktion jedoch lediglich für die Anwendung in Schülerlaboren.
Geräte und Chemikalien:
2 Bechergläser, 4 Reagenzgläser, Reagenzglasständer, Schnappdeckelglas, Glasrührstab, Standzylinder (10 mL), Trichter mit Filter, Filtriergestell, Stativmaterial, Wasserbad, Heizplatte, Thermometer, Ethanol (GHS02, GHS07), n-Heptan (GHS02, GHS07, GHS08, GHS09), Aceton (GHS02, GHS07), Stickstoffgas (GHS 04).
Versuchsdurchführung:
Unter dem Abzug wird Eigelb (vom Eiklar getrennt) in einem Becherglas mit 10 mL Ethanol versetzt und beides mit einem Glasstab homogenisiert (siehe Abbildung 76A). Das Gemisch wird mit 12,5 mL n-Heptan versetzt und der entstehende Niederschlag abfiltriert. Das Filtrat wird in einem 30 °C warmen Wasserbad eingedampft, bis sich eine Emulsion bildet. Die entstandene Emulsion wird mit 5 mL Aceton versetzt, gut durchmischt und das überstehende Aceton abgegossen. Der Vorgang wird mit dem Rückstand drei Mal wiederholt. Anschließend wird der Rückstand in 5 mL n-Heptan aufgenommen und kann so in einem Schnappdeckelglas kühl gelagert werden. Für die weitere Verwendung kann das Lösungsmittel abgedampft werden
Beobachtung:
Nach Zugabe des n-Heptans fällt ein Feststoff aus. Sowohl das Filtrat als auch das Acetongemisch besitzen eine gelbe Farbe. Nach dem Abdampfen des n-Heptans bleibt ein wachsartiger, hellgelber Feststoff zurück (siehe Abbildung).

Abbildung: Eigelb wird zunächst mit Ethanol homogenisiert (A). Nach Zugabe von n-Heptan wird abfiltriert (B) und das Lösemittel eingedampft (C). Die entstandene Emulsion (D) nach dreimaligen Waschen mit Aceton (E).
Deutung:
Bei Zugabe des n-Heptans fallen die in unpolaren Lösungsmitteln unlöslichen Bestandteile des Eigelbs, wie Proteine und Kohlenhydrate, aus. Dahingegen lösen sich Lecithin und andere Lipide in n-Heptan. Durch Zugabe von Aceton werden Fette sowie die Farbstoffe des Eigelbs gelöst, wobei Lecithin als Feststoff ausfällt. Die gewonnenen Lecithine gehören zur Gruppe der Phosphatidylcholine (vgl. Abbildung 13, S. 39), die zu den Phospholipiden gehören und in tierischen und pflanzlichen Zellmembranen vorkommen.
Anmerkungen zur Deutung:
Bitte beachten Sie die Anmerkungen zur Deutung der Experimente im separten Beitrag.
Litertaur:
- von Hoff, E., Milsch, N., Ehlers, M., Waitz, T., & Mey, I. (2017). Membranforschung für die Öffentlichkeit: Ein Kooperationsprojekt zwischen Fachdidaktik und Fachwissenschaft. CHEMKON, 24(4), 165–169. DOI: 10.1002/ckon.201790002.
- Palacios, L. E., & Wang, T. (2005). Extraction of egg-yolk lecithin. Journal of the American Oil Chemists' Society, 82(8), 565–569. DOI: 10.1007/s11746-005-1110-5.
- von Hoff, E. (2020). Entwicklung und Evaluation von Konzepten und Formaten zum Wissenstransfer von der Forschung in die Schule und Öffentlichkeit - Am Beispiel des SFB 803 (Dissertation). Georg-August-Universität Göttingen, Göttingen. Abrufbar unter http://hdl.handle.net/21.11130/00-1735-0000-0005-14C7-4.
Herstellung von Lipidfilmen durch Quellen
Bei dieser für SuS adaptierten Forschungsmethode zur Herstellung von Vesikeln können entweder die Lipide aus der Lipidextraktion aus Eigelb oder käuflich erworbenes Egg PC verwendet werden. Eine Durchführung der Synthese ist grundsätzlich auch im Unterricht denkbar, eignet sich aufgrund der hohen Wartezeiten jedoch eher für ein Schülerlabor.
Geräte und Chemikalien:
3 Bechergläser, Reagenzglas, Reagenzglasständer, Glasrührstab, Stativmaterial, Pasteurpipette, Kolbenhubpipette, Wasserbad, Heizplatte, Thermometer, Objektträger mit Vertiefung, Licht- oder Fluoreszenzmikroskop, demin. Wasser, n-Heptan (GHS02, GHS07, GHS08, GHS09), Lecithin (Experiment 6.1a oder Egg PC), Saccharoselösung (1 M), Glucoselösung (1 M), Texas Red DHPE (1,2-Dihexadecanoyl-sn-Glycero-3-Phosphoethanolamin; optional).
Versuchsdurchführung:
Unter dem Abzug werden in einem Becherglas 0,2 g Lecithin in 3 mL n-Heptan gelöst. 2,75 mL der Lösung werden in ein Reagenzglas überführt und in einem Wasserbad langsam auf 30 °C erhitzt. Mithilfe einer Pasteurpipette wird vorsichtig ein Stickstoffgasstrom auf die Lösung gerichtet, um das Lösungsmittel zu verdampfen. Nach dem Verblasen des Lösungsmittels werden 5 mL Saccharoselösung in das Reagenzglas gegeben und dieses für 60 Minuten ruhen gelassen. Daraufhin werden 15 µL Glucoselösung in die Vertiefung eines Objektträgers gegeben und weitere 15 µL der Lecithinlösung hinzupipettiert. Anschließend wird die Probe unter dem Mikroskop betrachtet.
Optional: Für die Fluoreszenzmarkierung des Lipidfilms kann eine 0,7 M Texas Red-Lösung in n-Heptan hergestellt und 38 μL der Texas Red-Lösung zu Beginn mit den 2,75 mL der Lecithinlösung gemischt werden. Anschließend wird in gleicher Weise wie mit der reinen Lecithinlösung verfahren und die Probe schließlich unter einem Fluoreszenzmikroskop betrachtet.
Beobachtung:
Im Falle der Zugabe von Texas Red-Lösung bleibt nach dem Verdampfen des Lösungsmittels ein leicht rötlicher Feststoff an der Gefäßwand zurück. Der Rückstand löst sich nach Zugabe der Saccharoselösung vom Gefäßrand ab und die Lösung trübt sich leicht. Unter dem Mikroskop sind kleine, blasenartige runde Strukturen zu erkennen, die bei Anregung mit grünem Licht rot fluoreszieren (siehe Abbildung).
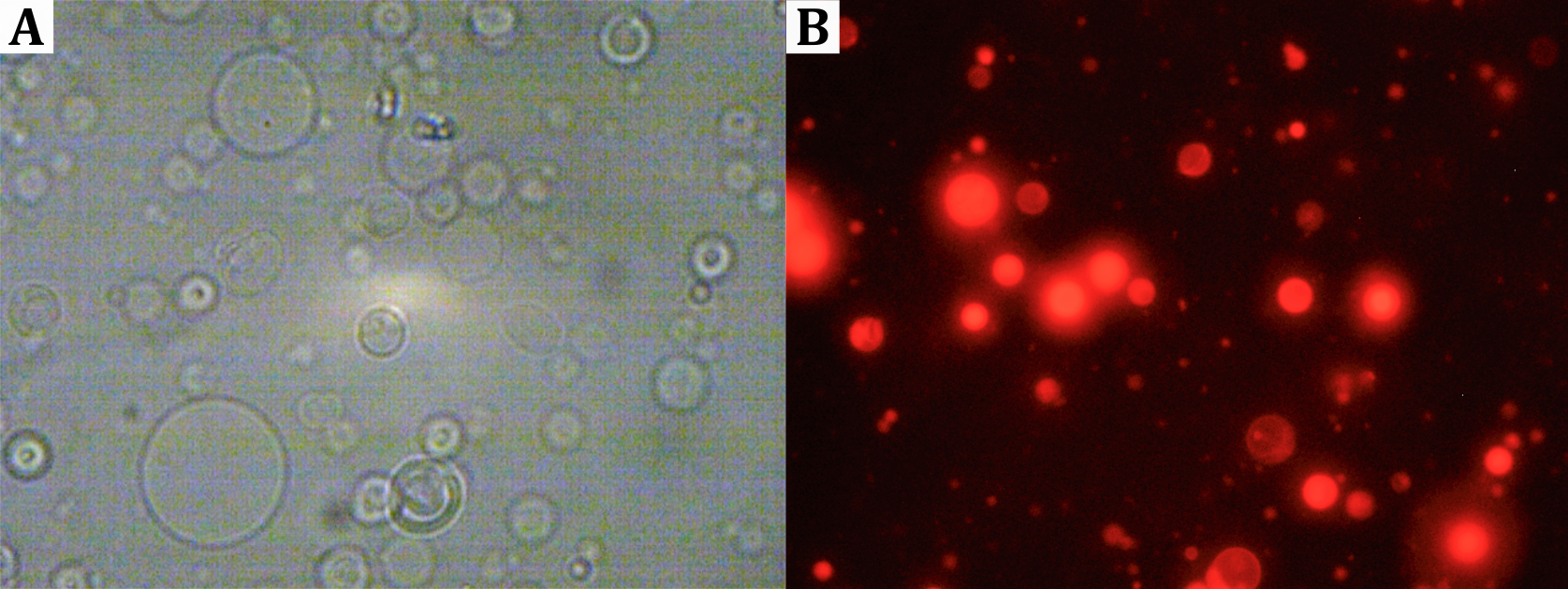
Abbildung: (A) Durchlichtmikroskopische Aufnahmen von Vesikeln. (B) Fluoreszenzmikroskopische Aufnahmen Texas Red-markierter Vesikel.
Deutung:
Lecithin löst sich in n-Heptan und bei Zugabe von Texas Red verteilt sich dieses homogen in der Lösung. Nach dem Verblasen des Lösungsmittels bleiben geordnete Lipidfilme an der Reagenzglaswand zurück. Bei Zugabe der Saccharoselösung lösen sich einzelne Lipidschichten von der Gefäßwand ab und lagern sich aufgrund des hydrophoben Effekts zu Vesikeln zusammen. Die Vesikel sind dabei so groß, dass sie unter dem Mikroskop betrachtet werden können. Die verschiedenen Brechungsindizes der Saccharoselösung im Inneren der Vesikel und der Glucoselösung als Außenmedium erleichtern die Betrachtung der Vesikel insbesondere unter dem Lichtmikroskop (Stein et al., 2017).
Anmerkungen zur Deutung:
Bitte beachten Sie die Anmerkungen zur Deutung der Experimente im separten Beitrag.
Litertaur:
- von Hoff, E., Milsch, N., Ehlers, M., Waitz, T., & Mey, I. (2017). Membranforschung für die Öffentlichkeit: Ein Kooperationsprojekt zwischen Fachdidaktik und Fachwissenschaft. CHEMKON, 24(4), 165–169. DOI: 10.1002/ckon.201790002.
- Akashi, K., Miyata, H., Itoh, H., & Kinosita, K. (1996). Preparation of giant liposomes in physiological conditions and their characterization under an optical microscope. Biophysical Journal, 71(6), 3242–3250. DOI: 10.1016/S0006-3495(96)79517-6.
- Stein, H., Spindler, S., Bonakdar, N., Wang, C., & Sandoghdar, V. (2017). Production of Isolated Giant Unilamellar Vesicles under High Salt Concentrations. Frontiers in Physiology, 8, 63. DOI: 10.3389/fphys.2017.00063.
- von Hoff, E. (2020). Entwicklung und Evaluation von Konzepten und Formaten zum Wissenstransfer von der Forschung in die Schule und Öffentlichkeit - Am Beispiel des SFB 803 (Dissertation). Georg-August-Universität Göttingen, Göttingen. Abrufbar unter http://hdl.handle.net/21.11130/00-1735-0000-0005-14C7-4.
Anmerkungen zur Deutung der Experimente
Folgende Anmerkungen sollten bei der Auswertung der Versuche Lipidextraktion aus Eigelb – Isolation von Lecithin und Herstellung von Lipidfilmen durch Quellen beachtet werden.
In der Membranforschung existieren zur Herstellung von Vesikeln im allgemeinen zwei Methoden – das Quellen und die Elektroformation (Stein et al., 2017). Beide Methoden ermöglichen es GUVs (giant unilamellar vesicles) mit spezifischen Zusammensetzungen zu synthetisieren, die anschließend mithilfe verschiedener Techniken untersucht werden können.
Beim Quellen werden Lipidmoleküle zunächst in einem organischen Lösungsmittel gelöst. Anschließend wird das Lösungsmittel durch Verblasen verdampft. Dabei ordnen sich die Lipidmoleküle zu mehreren Lipiddoppelschichten zusammen, die sich an der Gefäßwand anlagern. Die Zugabe einer Pufferlösung sorgt dafür, dass diese auch zwischen die jeweiligen Doppelschichten gelangt. Um verschiedenen Kräften wie dem osmotischen Druck, elektrostatischer Abstoßung zwischen den Lipidköpfen und der Interaktion der hydrophoben Lipidbestandteile an den Seiten der Membranen mit dem wässrigen Medium weniger ausgesetzt zu sein, quellen die Lipidschichten auf und bilden Vesikel aus (siehe Abbildung). Dieser recht langsame Prozess kann beispielsweise durch die gezielte Wahl von ionischen Kopfgruppen oder der Zugabe von Saccharose beschleunigt werden (Stein et al., 2017).
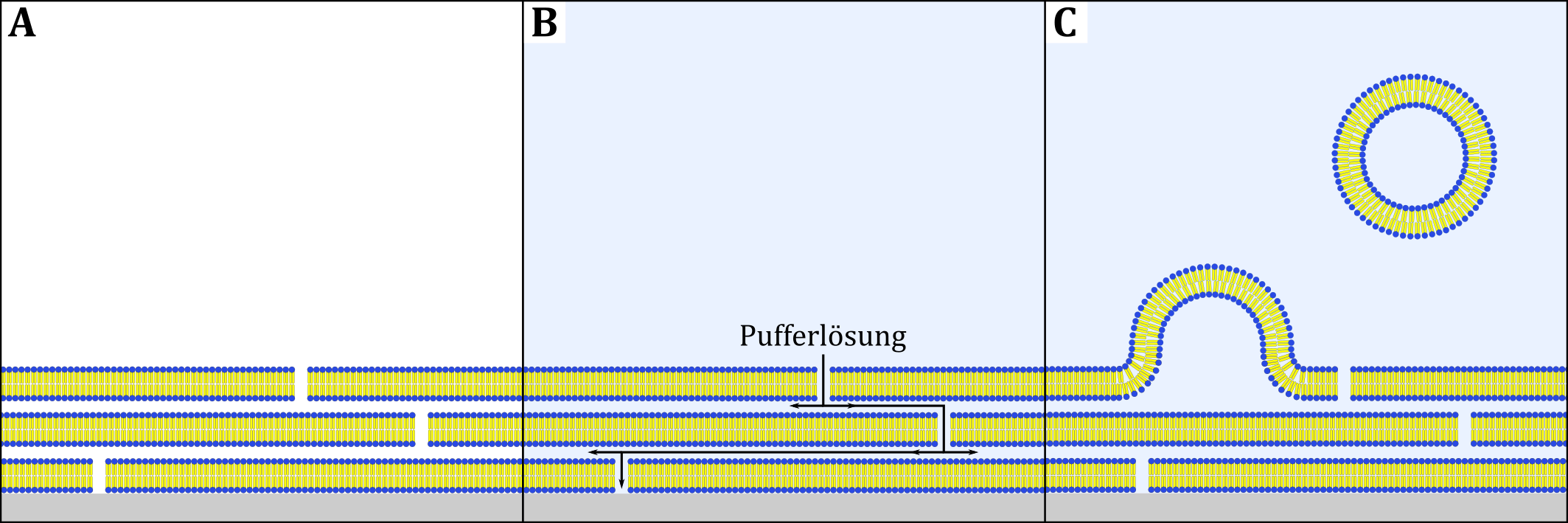
Abbildung: Schematische Darstellung der Vesikelpräparation durch Quellen nach Stein et al. (A) Lipiddoppelschichten nach Verblasen des Lösungsmittels, (B) Zugabe einer Pufferlösung, (C) Aufquellen der Lipidschichten zu Vesikeln.
Bei der Elektroformation wird zunächst ähnlich vorgegangen wie beim Quellen, nach der Zugabe des Puffers wird jedoch eine Spannung angelegt, die die Formierung von Vesikeln durch u.a. elektrostatische Wechselwirkungen zwischen dem elektrischen Feld und den Lipidladungen sowie der Veränderung der Intermembrankräfte durch Umverteilung der Gegenionen zusätzlich begünstigt (s. Abbildung) (Dimitrov & Angelova, 1987).
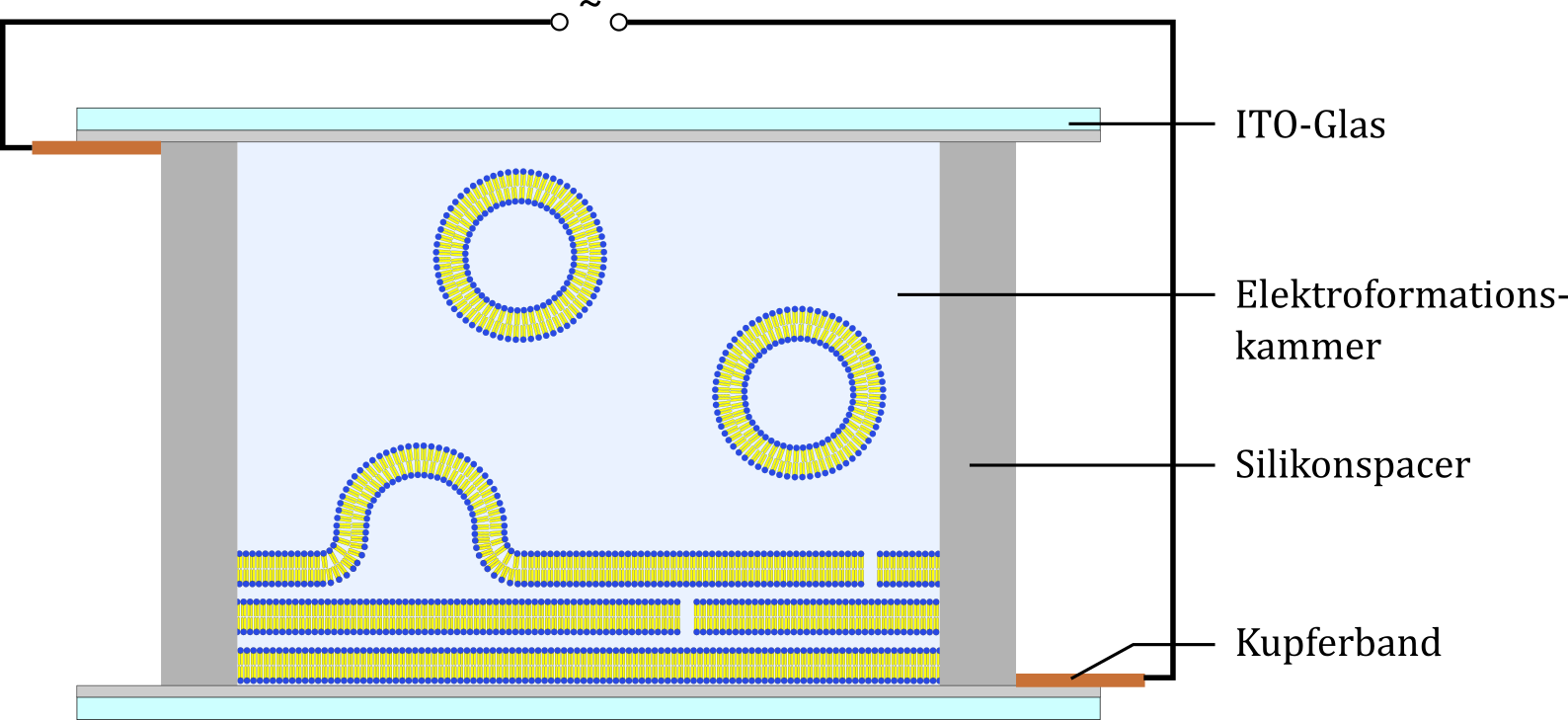
Abbildung: Schematische Darstellung der Vesikelpräparation in einer Elektroformationskammer nach Stein et al.
Die für die Synthese der Vesikel benötigen Lipide können entweder in Form von Egg PC käuflich erworben, oder anhand der Versuchsanleitung aus Eigelb extrahiert werden. Sowohl die Extraktion als auch das Quellen der Lipidfilme ist jedoch sehr zeitintensiv, weshalb sich die Versuche eher für die Verwendung in Schülerlaboren eignen, zumal die meisten Schulen keinen Zugang zu einem Fluoreszenzmikroskop besitzen.
Litertaur:
- Stein, H., Spindler, S., Bonakdar, N., Wang, C., & Sandoghdar, V. (2017). Production of Isolated Giant Unilamellar Vesicles under High Salt Concentrations. Frontiers in Physiology, 8, 63. DOI: 10.3389/fphys.2017.00063.
- Dimitrov, D. S., & Angelova, M. I. (1987). Lipid swelling and liposome formation on solid surfaces in external electric fields. Progress in Colloid & Polymer Science, 73, 48–56.
- von Hoff, E. (2020). Entwicklung und Evaluation von Konzepten und Formaten zum Wissenstransfer von der Forschung in die Schule und Öffentlichkeit - Am Beispiel des SFB 803 (Dissertation). Georg-August-Universität Göttingen, Göttingen. Abrufbar unter http://hdl.handle.net/21.11130/00-1735-0000-0005-14C7-4.
Fluoreszenzmarkierte Fusion von Seifenblasen
Dieses Modellexperiment zur Fusion von Vesikeln ist universell einsetzbar und kann auch von jüngeren Schüler*innen durchgeführt werden.
Geräte und Chemikalien:
2 Bechergläser (100 mL), Messzylinder, Glasrührstab, 2 Seifenblasendosen mit Ringen, UV-Lampe, Wasser, Puderzucker, Glycerin, Spülmittel.
Versuchsdurchführung:
In zwei Bechergläsern werden jeweils in 50 mL Wasser 25 mL Spülmittel, 10 mL Glycerin und 25 g Puderzucker vermischt, wobei zu einer der Lösungen noch eine Spatelspitze Pyranin hinzugegeben wird. Die beiden Lösungen werden einige Stunden ruhen gelassen und anschließend vorsichtig gerührt. Mit beiden Seifenblasenlösungen wird möglichst gleichzeitig eine kleine Seifenblase erzeugt und diese auf dem jeweiligen Seifenblasenring aufgefangen. Die Seifenblasen werden mit UV-Licht bestrahlt und die Pyranin enthaltende Blase von oben vorsichtig auf die Seifenblase ohne Pyranin gelegt, so dass eine gemeinsame Seifenhaut entsteht.
Beobachtung:
Die Seifenblase mit Pyranin fluoresziert grün unter UV-Licht. Werden die beiden Seifenblasen aufeinandergelegt, bildet sich eine gemeinsame Grenzflächenschicht, die ebenfalls fluoresziert. Zudem ziehen sich nach kurzer Zeit auch fluoreszierende Schlieren durch die Membran der zuvor nicht fluoreszierenden Seifenblase (siehe Abbildung).

Abbildung: (A) Mit Pyranin versetze Seifenblase. (B) Beim Aufeinanderlegen zweier Seifenblasen, wird der fluoreszierende Farbstoff der oberen Seifenblase auf die untere Seifenblase übertragen (C). Aufgrund der schlechten Sichtbarkeit der Fluoreszenz auf Fotografien zeigt (D) eine schematische Darstellung der beschrieben Ereignisse.
Deutung:
Zwischen den Tensidschichten der Seifenblasen befinden sich sowohl die Wassermoleküle, als auch – im Falle der Pyraninlösung – die Farbstoffmoleküle. Werden die beiden Blasen aufeinandergelegt, bildet sich eine gemeinsame Grenzschicht, die lediglich aus einer Tensiddoppelschicht besteht und beide Seifenblasen miteinander verbindet. Die zwischen den Tensidschichten eingebetten Moleküle können somit ungehindert von einer Seifenblase zur anderen wechseln, wodurch, der Schwerkraft folgend, deutlich fluoreszierende Schlieren in der unteren Seifenblase zu beobachten sind.
Literatur:
- von Hoff, E. (2020). Entwicklung und Evaluation von Konzepten und Formaten zum Wissenstransfer von der Forschung in die Schule und Öffentlichkeit - Am Beispiel des SFB 803 (Dissertation). Georg-August-Universität Göttingen, Göttingen. Abrufbar unter http://hdl.handle.net/21.11130/00-1735-0000-0005-14C7-4.

