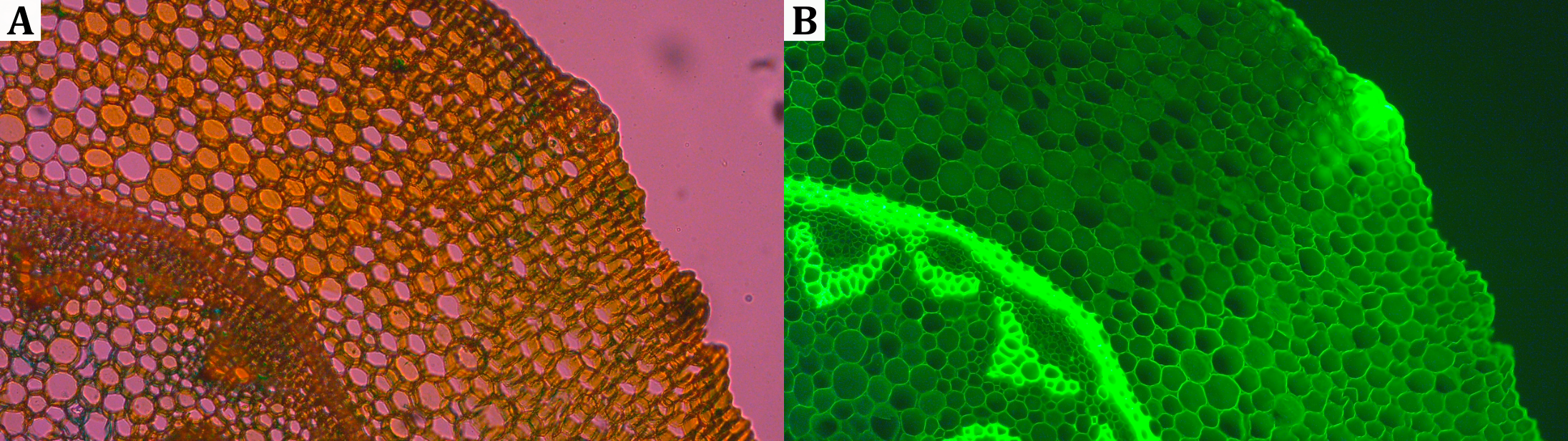
(A) Mikroskopische Aufnahmen des Sprossquerschnitts eines Maiglöckchens (Convallaria majalis), (B) Eigenfluoreszenz nach Anregung mit UV-Licht.
In diesem Themenfeld finden Sie acht Experimente als Exkurs-Mögleichkeit zu den Hintergründen der Fluoreszenz und der Fluoreszenzmikroskopie:
- Strukturelle Abhängigkeit der Fluoreszenz
- Anregung von Fluoreszenzfarbstoffen
- Knicklichter – alternative Anregungsmöglichkeiten von Fluoreszenzfarbstoffe
- Sensitivität von Fluoreszenzfarbstoffen
- Quenching-Effekt
- Self-quenching von Pyranin
- Förster-Resonanztransfer (FRET)
- Fluorochromierung von Pflanzenbestandteilen
Bitte beachten Sie bei den Experimenten zum Quenching die Anmerkungen zur Deutung der Experimente. Zusätzlich bietet sich in diesem Exkurs die Betrachtung des Modellexperiments Fluoreszenzmarkierte Fusion von Seifenblasen aus dem Themenfeld 5 – Untersuchungsmethoden in der Membranforschung an.
Self-quenching von Pyranin
Auch der Self-quenching-Effekt findet in in der Forschung Anwendung. Entsprechend kann der Effekt zuvor ebenfalls anhand dieses Versuchs erarbeitet werden.
Geräte und Chemikalien:
Schnappdeckelglas, Messpipette (5 mL), Spatel, Glasrührstab, demin. Wasser, Pyranin (GHS07).
Versuchsdurchführung:
In ein Schnappdeckelglas werden unter UV-Licht nach und nach jeweils wenige Kristalle Pyranin in 1 mL Wasser gelöst.
Beobachtung:
Nach Zugabe erster weniger Kristalle Pyranin zu Wasser fluoresziert die Lösung leicht grün. Die stetige Zugabe weiterer Kristalle sorgt zunächst für eine Intensivierung der Fluoreszenz, die bei weiterer Zugabe wieder abnimmt (siehe Abbildung).

Abbildung: Pyraninlösung unter UV-Licht bei sukzessiver Zugabe von Pyraninkristallen.
Deutung:
Die Intensität der Fluoreszenz der Pyraninlösung hängt von der Konzentration der Pyraninmoleküle ab. Mit steigender Konzentration steigt zunächst auch die Fluoreszenzintensität, was mit der zunehmenden gleichzeitigen Anregung der Fluorophore erklärt werden kann. Ab einer gewissen Konzentration sinkt jedoch die Intensität wieder. Analog zum Experiment Quenching-Effekt kommt es bei steigender Konzentration vermehrt zu Stoßprozessen der Moleküle, bei denen die Energie von einem Fluorophormolekül auf ein anderes übertragen wird. In Abwesenheit von nicht-fluoreszierenden Stoßpartnern wie Halogenidionen kommt es bei Erhöhung der Fluorophorkonzentration zusätzlich zur Ausbildung nicht-fluoreszierender Dimere der Farbstoffmoleküle, die zusätzlich für die Energieübertragung zur Verfügung stehen.
Anmerkungen zur Deutung:
Bitte beachten Sie die Anmerkungen zur Deutung der Experimente im separten Beitrag.
Litertaur:
- von Hoff, E. (2020). Entwicklung und Evaluation von Konzepten und Formaten zum Wissenstransfer von der Forschung in die Schule und Öffentlichkeit - Am Beispiel des SFB 803 (Dissertation). Georg-August-Universität Göttingen, Göttingen. Abrufbar unter http://hdl.handle.net/21.11130/00-1735-0000-0005-14C7-4.
Anmerkungen zur Deutung der Experimente
Folgende Anmerkungen sollten bei der Auswertung der Versuche Quenching-Effekt und Self-quenching von Pyranin beachtet werden.
Das Phänomen des Quenchings von Fluoreszenz wird in der Forschung gezielt angewendet, um bspw. die Fusion von Lipidmembranen oder die Faltung von Proteinen beobachten zu können. Dabei wird ausgenutzt, dass bei räumlicher Nähe von Fluorophoren eine Energieübertragung stattfindet, die für eine Löschung der Fluoreszenz sorgt. Obwohl das Phänomen seit über einem Jahrhundert untersucht wird, konnte der dahinterliegende Mechanismus noch immer nicht gänzlich geklärt werden. In der Literatur lassen sich einige Theorien finden, die auf ein Zusammenspiel verschiedener physikalischer Effekte hindeuten. Während die Theorie der Energieübertragung auf nicht-fluorophore Stoßpartner für die Deutung des Versuchs Quenching-Effekt in schulischen Kontexten ausreichend ist, vermag diese nicht zufriedenstellend zu erklären, wieso Pyraninmoleküle bei hoher Konzentration dem Self-quenching-Effekt unterliegen. Eine mögliche Erklärung dieses Phänomens ist die Bildung nicht-fluoreszierender Dimere, die mit einer Veränderung des Energiestufenprofils einhergeht (Förster, 1946). Anhand dieser Theorie kann die Energieübertragung beider Versuchsteile im Sinne einer didaktischen Reduktion auf das Energiestufendiagramm in Abbildung B reduziert werden.
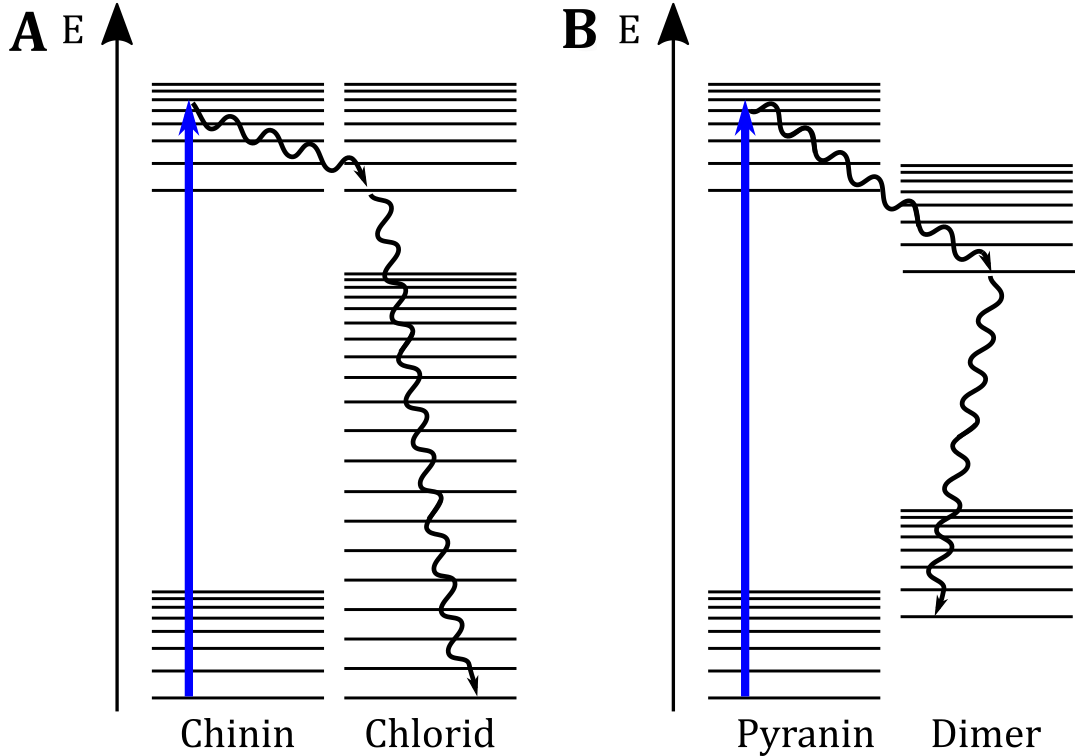
Abbildung: (A) Jabłoński-Diagramm für die strahlungslose Energieübertagung auf einen Stoßpartner mit unterschiedlichem Energieprofil. (B) Veranschaulichung einer möglichen Erklärung für das Phänomen des Self-quenching-Effekts.
Litertaur:
- Forster, T. (1946). Energiewanderung und Fluoreszenz. Die Naturwissenschaften, 33(6), 166–175. DOI: 10.1007/BF00585226.
- von Hoff, E. (2020). Entwicklung und Evaluation von Konzepten und Formaten zum Wissenstransfer von der Forschung in die Schule und Öffentlichkeit - Am Beispiel des SFB 803 (Dissertation). Georg-August-Universität Göttingen, Göttingen. Abrufbar unter http://hdl.handle.net/21.11130/00-1735-0000-0005-14C7-4.
Förster-Resonanztransfer (FRET)
FRET-Effekte werden in der Forschung zum Teil explizit ausgenutzt, an anderer Stelle sollen sie vermieden werden.
Geräte und Chemikalien:
3 Schnappdeckelgläser, Laserpointer (violett, grün), 2 Textmarkerlösungen (grüne und gelbe Fluoreszenz).
Versuchsdurchführung:
In zwei Schnappdeckelgläser werden je eine grün bzw. gelb fluoreszierende Textmarkerlösung nacheinander mit einem violetten und einem grünen Laserstrahl durchleuchtet. Anschließend wird jeweils eine Hälfte der beiden Lösungen in ein drittes Schnappdeckelglas überführt. Das Gemisch wird ebenfalls nacheinander mit dem Licht der zwei Laser durchstrahlt.
Beobachtung:
Die Fluoreszenz der gelb fluoreszierenden Lösung ist sowohl bei Bestrahlung mit einem violetten als auch einem grünen Laserstrahl zu beobachten. Die Fluoreszenz der grün fluoreszierenden Lösung ist hingegen nur bei Bestrahlung mittels des violetten Laserstrahls zu sehen. Das Gemisch zeigt beim Durchleuchten mit beiden Lasern jeweils eine gelbe Fluoreszenz (siehe Abbildung).

Abbildung: Beobachtete Fluoreszenz bei Anregung einer grün fluoreszierenden (links), einer gelb fluoreszierenden (Mitte) und einer Mischung aus den ersten beiden Lösungen (rechts) mit einem violetten und einem grünen Laserstrahl.
Deutung:
Das Licht des violetten Lasers ist energiereich genug, um die Moleküle der beiden Lösungen sowohl zur grünen als auch zur gelben Fluoreszenzemission anzuregen. Die Energie des grünen Laserstrahls reicht hingegen lediglich aus, um den gelb emittierenden Farbstoff anzuregen. Werden beide Lösungen gemischt, liegen beide Farbstoffe nebeneinander in Lösung vor. Das Licht des grünen Lasers wird weiterhin nur vom gelb emittierenden Fluoreszenzfarbstoff absorbiert. Mithilfe des violetten Laserstrahls können hingegen beide Farbstoffe angeregt werden. Überlappt dabei das Emissionsspektrum des einen Fluorophors (grüne Emission, energiereicher) mit dem Absorptionsspektrum des anderen Fluorophors, dann wird die Emissionsenergie auf diesen übertragen, so dass die energieärmere Fluoreszenzfarbe wahrnehmbar ist (vgl. Abbildung). Vereinfacht kann die Emission dabei als Aneinanderreihung von Stokes-Verschiebungen verstanden werden.
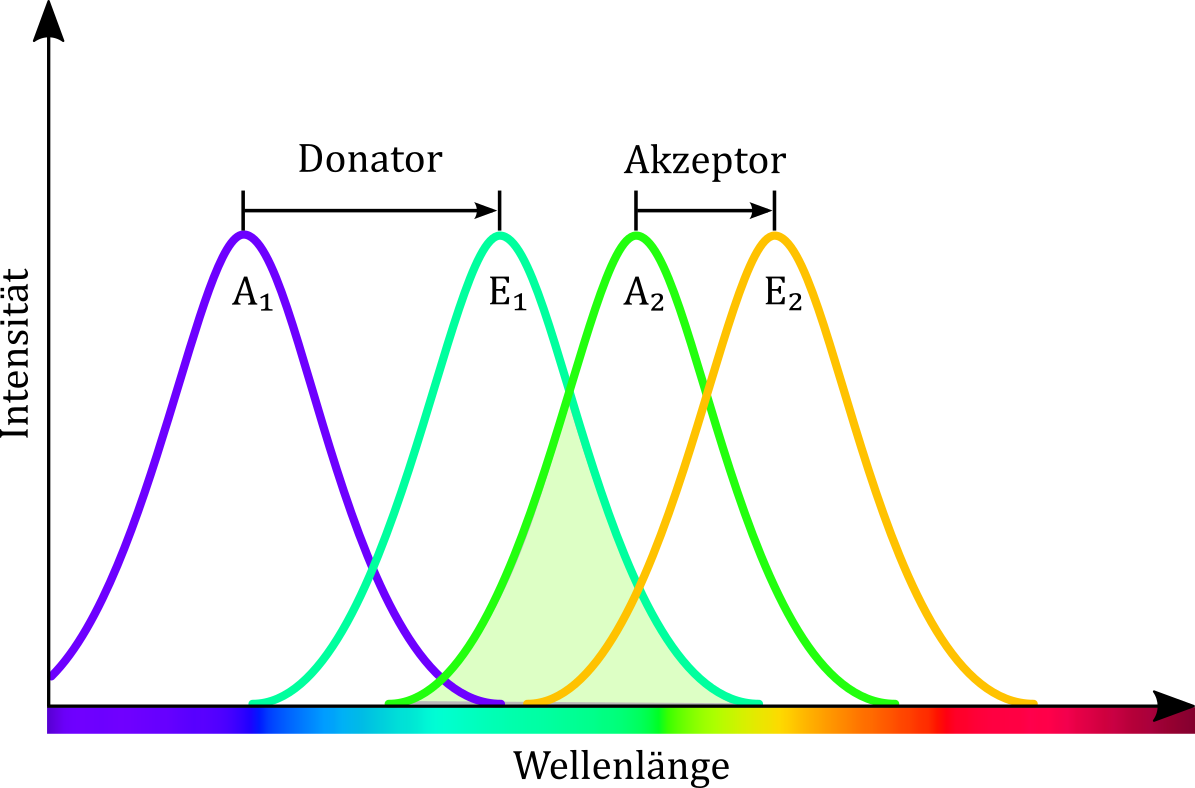
Abbildung: Das Emissionsspektrum des ersten Farbstoffs (E1) überlappt mit dem Absorptionsspektrum des zweiten Farbstoffs (A2). Dies ermöglicht eine Energieübertragung vom ersten auf den zweiten Farbstoff, so dass es bei der Farbstoffmischung bei Anregung mit beiden Lasern zu einer gelben Fluoreszenz kommt.
Anmerkungen zur Deutung des Experiments:
Das Modellexperiment zum Förster-Resonanztransfer (FRET) ermöglicht es, die strahlungslose Energieübertragung von einem angeregten Farbstoff auf einen zweiten Farbstoff phänomenologisch zu betrachten. Eine strahlungslose Energieübertragung nach Förster ist dann möglich, wenn sich zwei unterschiedliche Farbstoffmoleküle in einem Abstand von ca. 5 bis 10 nm befinden und das Emissionsspektrum des Donatorfarbstoffs mit dem Absorptionsspektrum des Akzeptorfarbstoffs überlappt (Wöhrle & Tausch, 1998). Ist dies der Fall, wird die Energie des angeregten Donators basierend auf Dipol-Dipol-Wechselwirkungen strahlungslos an das Akzeptormolekül abgegeben, welches dadurch in einen angeregten Zustand versetzt wird. Unter Abgabe eines Photons kehrt der Akzeptorfarbstoff schließlich in seinen Grundzustand zurück (Clegg, 2009). Der FRET-Effekt kann sowohl mithilfe von vereinfachten Jabłoński-Diagrammen veranschaulicht werden (siehe Abbildung) als auch anhand des Vergleichs von Emissionsspektren der Farbstoffmischungen (vgl. Abbildung) verdeutlicht werden.
Die Bedingung, dass sich die Farbstoffmoleküle für einen FRET bis auf wenige Nanometer nahekommen müssen, wird auch in der Membranforschung ausgenutzt, um bspw. Proteine in einer Membran zu lokalisieren und Protein-Protein-Interaktionen abzubilden (Berney & Danuser, 2003; Giepmann et al., 2006). Ein ungewolltes Auftreten des FRET-Effekts kann jedoch auch dazu führen, dass Fluoreszenzfarbstoffe für bestimmte experimentelle Arbeiten nicht geeignet sind. Auch die Natur nutzt zudem den FRET-Effekt, um den Prozess der Photosynthese effektiver zu gestalten. Dazu absorbieren Pigmente des Lichtsammelkomplexes die Energie einfallenden Lichts und transferieren diese z. T. mehrere hundert Ångström weit zum Reaktionszentrum (Şeneret al., 2011).

Abbildung: Darstellung des FRET-Effektes im Jabłoński-Diagramm. (A) der grün fluoreszierende Farbstoff kann nur mithilfe des violetten Lasers zur Fluoreszenz angeregt werden. (B) Der gelb fluoreszierende Farbstoff kann von beiden Lasern zu Fluoreszenz angeregt werden. (C) Bei Anregung der Farbmischung mit einem violetten Laser kommt es zur Energieübertragung auf das zweite Fluorophor, so dass eine Emission gelben Lichts folgt.
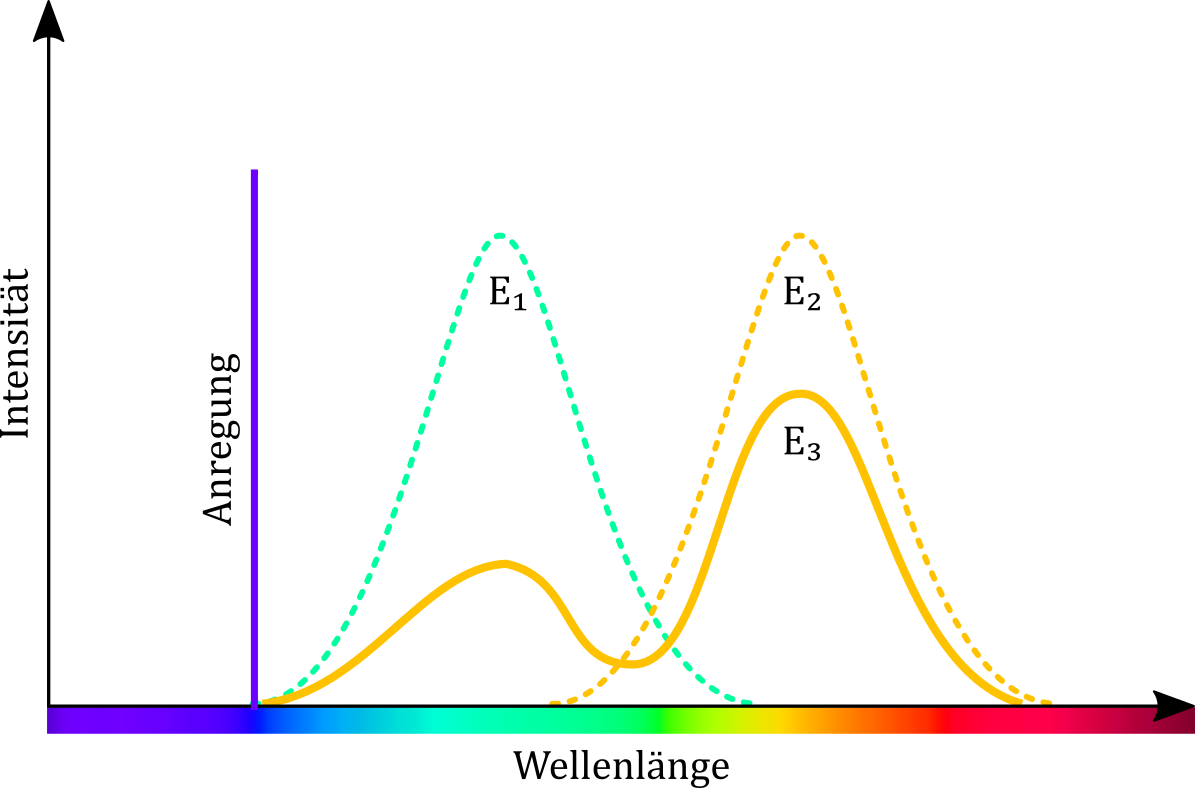
Abbildung: Emissionsspektren der Farbstoffmischungen nach Anregung mit einem violetten Laser nach Hochreiter et al. E1 und E2 sind theoretische Emissionsspektren für die einzelnen Farbstoffe. E3 verdeutlicht den FRET-Effekt. Das Integral von E3 entspricht dem von E1, der Peak bei E1 ist jedoch abgeschwächt, dafür bei E2 deutlich höher.
Literatur:
- Förster, T. (1946). Energiewanderung und Fluoreszenz. Die Naturwissenschaften, 33(6), 166–175. DOI: 10.1007/BF00585226.
- Wöhrle, D., Tausch, M. W., & Stohrer, W.‑D. (1998). Photochemie: Konzepte, Methoden, Experimente (1st ed.). Weinheim: Wiley-VCH.
- Clegg, R. M. (2009). Chapter 1 Förster resonance energy transfer—FRET what is it, why do it, and how it's done. In Laboratory Techniques in Biochemistry and Molecular Biology. Fret and Flim Techniques (Vol. 33, pp. 1–57). Elsevier. DOI: 10.1016/S0075-7535(08)00001-6.
- Berney, C., & Danuser, G. (2003). FRET or No FRET: A Quantitative Comparison. Biophysical Journal, 84(6), 3992–4010. DOI: 10.1016/S0006-3495(03)75126-1.
- Giepmans, B. N. G., Adams, S. R., Ellisman, M. H., & Tsien, R. Y. (2006). The fluorescent toolbox for assessing protein location and function. Science (New York, N.Y.), 312(5771), 217–224. DOI: 10.1126/science.1124618.
- Şener, M., Strümpfer, J., Hsin, J., Chandler, D., Scheuring, S., Hunter, C. N., & Schulten, K. (2011). Förster energy transfer theory as reflected in the structures of photosynthetic light-harvesting systems. Chemphyschem : A European Journal of Chemical Physics and Physical Chemistry, 12(3), 518–531. DOI: 10.1002/cphc.201000944.
- Hochreiter, B., Kunze, M., Moser, B., & Schmid, J. A. (2019). Advanced FRET normalization allows quantitative analysis of protein interactions including stoichiometries and relative affinities in living cells. Scientific Reports, 9(1), 8233. DOI: 10.1038/s41598-019-44650-0.
- von Hoff, E. (2020). Entwicklung und Evaluation von Konzepten und Formaten zum Wissenstransfer von der Forschung in die Schule und Öffentlichkeit - Am Beispiel des SFB 803 (Dissertation). Georg-August-Universität Göttingen, Göttingen. Abrufbar unter http://hdl.handle.net/21.11130/00-1735-0000-0005-14C7-4.
Fluorochromierung von Pflanzenbestandteilen
Dieser Versuch bedarf dem vorherigen Einlegen von Pflanzenbestandteilen in Textmarkerlösung, eignet sich im Anschluss jedoch für makro- und mikroskopische Betrachtungen unter UV-Licht im Unterricht.
Geräte und Chemikalien:
Schnappdeckelgläschen, Topfpflanze mit weißen Blüten (Begonien und Petunien sind besonders geeignet), Objektträger, Mikroskopierbesteck, Lichtmikroskop und UV-Lampe oder Fluoreszenzmikroskop, gelbe oder grüne Textmarkerlösungen.
Versuchsdurchführung:
Mehrere weiße Blüten werden so abgeschnitten, dass ihnen 1-2 cm ihres Stängels bleiben. Über Nacht werden die Stängel der Blüten in einer Fluoreszenzfarbstofflösung eingelegt und die Blüten schließlich in einem abgedunkelten Raum unter UV-Licht untersucht. Einige der Blüten und Querschnitte der Stängel werden zudem auf einem Objektträger präpariert und unter dem Fluoreszenzmikroskop untersucht. Alternativ können die Proben auch unter einem ausgeschalteten Lichtmikroskop untersucht werden, während die Proben von der Seite mit einer UV-Lampe beleuchtet werden.
Beobachtung:
Unter UV-Licht sind zelluläre Strukturen der Blüten zu erkennen, die bei Tageslicht nicht zu sehen waren (siehe Abbildung). Die Betrachtung der Proben unter dem Fluoreszenzmikroskop ermöglicht es zudem, noch feinere Strukturen zu erkennen, die bei normaler Lichteinstrahlung nicht oder nur kaum zu unterscheiden sind.
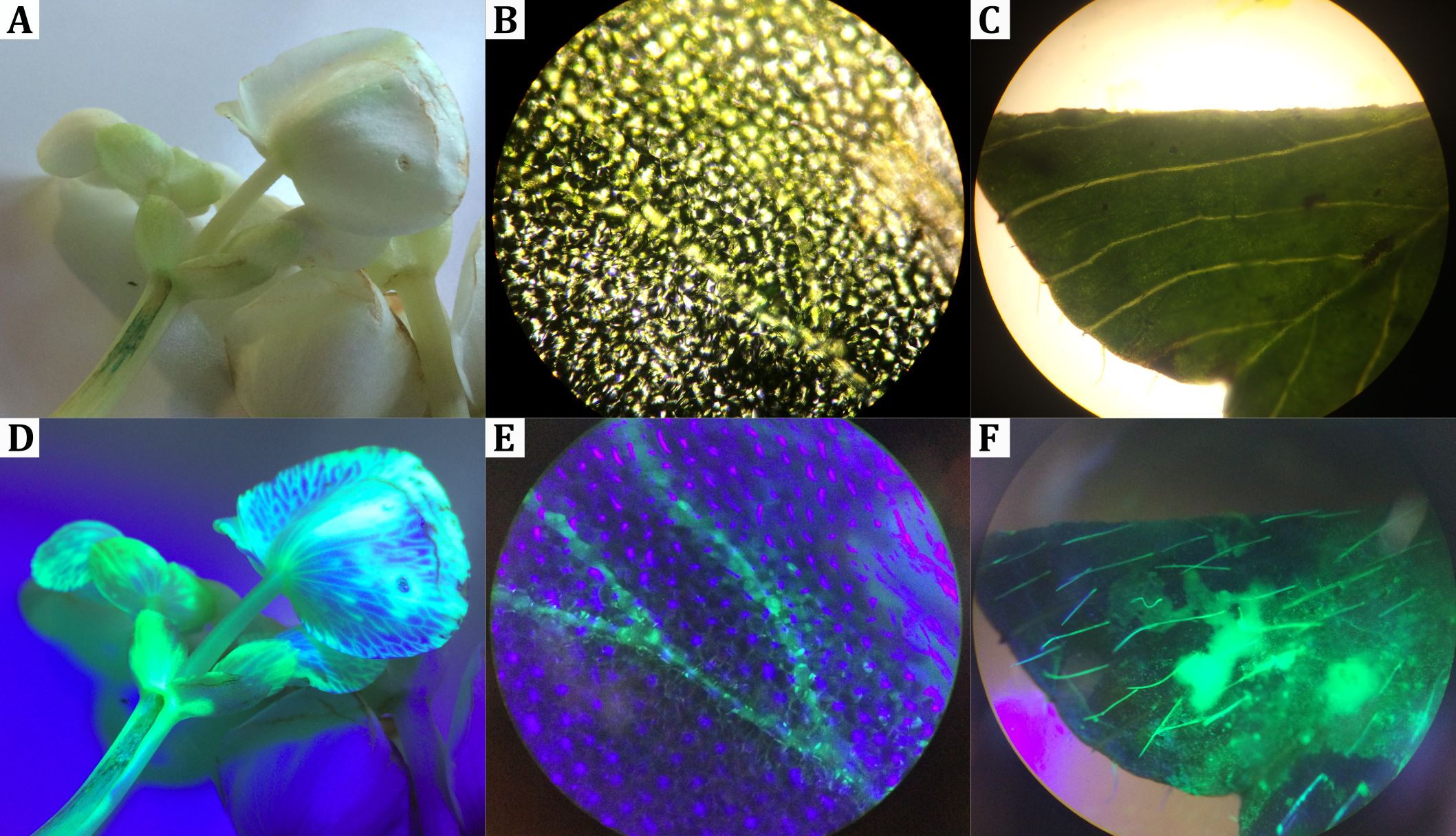
Abbildung: Vergleich fluoreszenzmarkierter Pflanzenbestandteile bei Tageslicht (oben) bzw. unter UV-Licht (unten). In (D) und (E) ist das Leitgewebe anhand der Fluoreszenz deutlich zu erkennen. In (F) fluoreszieren hydrophile Trichome.
Deutung:
Die Pflanzen nehmen über Nacht die Farbstofflösung auf. Dabei ist es den Farbstoffmolekülen vor allem aufgrund ihrer Größe nicht möglich, ungehindert in alle Zellen einzudringen. Bei Bestrahlung mit UV-Licht wird deshalb vor allem das Leitgewebe sichtbar, das innerhalb der Pflanze für den Transport von Wasser zuständig ist. Zudem treten die Pflanzenhaare (Trichome) deutlich hervor, da hydrophile Trichome von der Pflanze u. a. als Wasserspeicher genutzt werden.
Anmerkung zur Deutung:
Um die Bedeutung der Fluoreszenzmikroskopie auch in schulischen Kontexten verdeutlichen zu können ist es möglich, Blüten und andere Pflanzenbestandteile mit fluoreszierender Textmarkerlösung anzufärben. Während das Anfärben von Blüten mit blauer Tinte im Biologieunterricht häufig Anwendung findet, ermöglicht die Verwendung von fluoreszierenden Farbstofflösungen es dieses Experiment insofern zu erweitern, als eine Betrachtung des Leitgewebes, ähnlich wie in der Forschung, erst durch Bestrahlung mit UV-Licht möglich ist. Vergleichende mikroskopische Betrachtungen mithilfe der originären Lichtquelle bzw. einer sekundären UV-Lichtquelle verdeutlichen zudem, dass die Fluoreszenzmarkierung auch auf mikroskopischer Ebene eine Unterscheidung verschiedener Bestandteile des Präparats ermöglicht.
Literatur:
- von Hoff, E. (2020). Entwicklung und Evaluation von Konzepten und Formaten zum Wissenstransfer von der Forschung in die Schule und Öffentlichkeit - Am Beispiel des SFB 803 (Dissertation). Georg-August-Universität Göttingen, Göttingen. Abrufbar unter http://hdl.handle.net/21.11130/00-1735-0000-0005-14C7-4.
Seite 2 von 2

