Die Anregung von Fluoreszenzfarbstoffen mit Laserstrahlen verschiedener Wellenlängen ist aufgrund ihrer Reproduzierbarkeit flexibel anwendbar. Jedoch muss ein sorgsamer Umgang mit den Laserpointern gewährleistet sein.
Geräte und Chemikalien:
4 Schnappdeckelgläser, UV-Lampe, 3 Laserpointer (violett, grün, rot), 4 Lösungen mit blauer, grüner, gelber und roter Fluoreszenz (z. B. Textmarkerlösungen, Chlorophylllösung)
Versuchsdurchführung:
Vier Lösungen die blau, grün, gelb bzw. rot fluoreszieren werden nacheinander jeweils mit UV-Licht sowie einem violetten, grünen und roten Laserstrahl durchleuchtet.
Beobachtung:
Unter UV-Licht fluoreszieren alle Lösungen mit einer bestimmten Farbe. Werden die Lösungen mit einem violetten Laserstrahl durchleuchtet, ist bei allen vier Lösungen entsprechend ihrer Farbe unter UV-Licht der Strahlengang als Fluoreszenz wahrzunehmen. Wird ein grüner Laserstrahl verwendet, ist lediglich bei den Lösungen die gelb und rot fluoreszieren eine Fluoreszenz zu sehen. Unter Bestrahlung mit einem roten Laserstrahl ist in keiner der Lösungen eine Fluoreszenz wahrnehmbar (vgl. Abbildung).
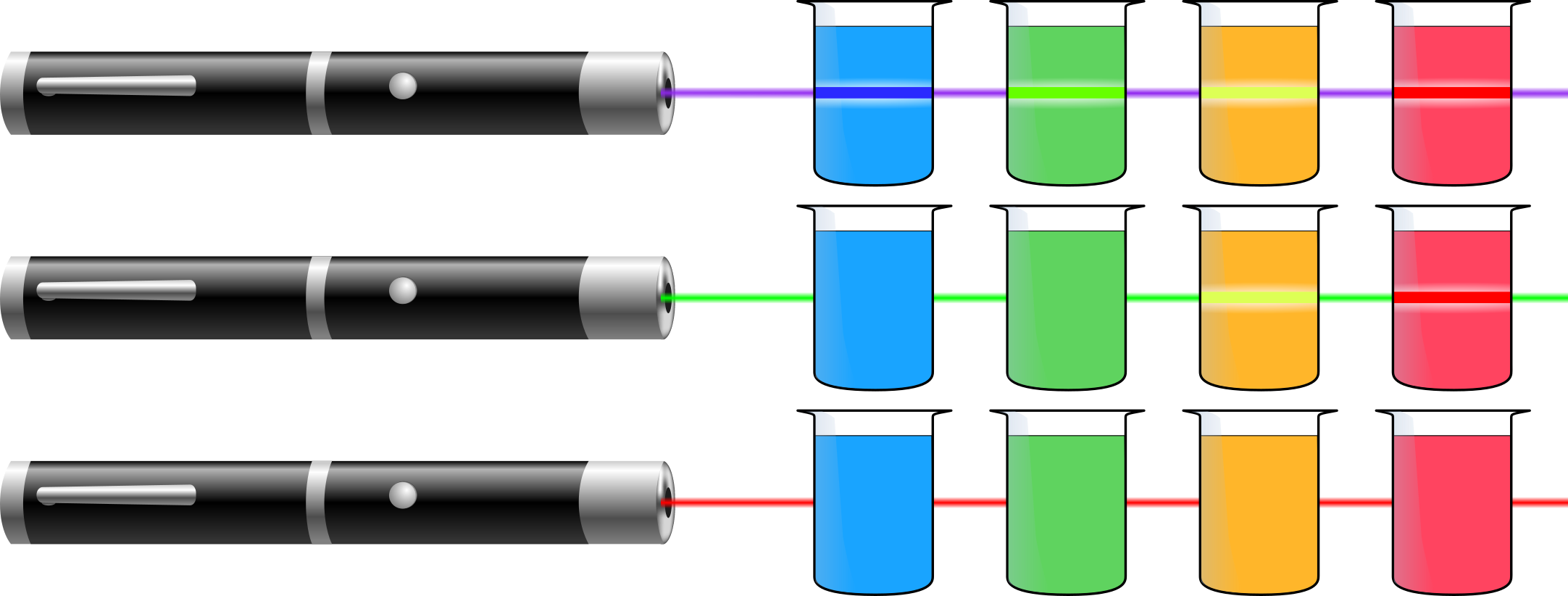
Abbildung: Beobachtete Fluoreszenz verschiedenfarbig fluoreszierender Lösungen nach Anregung mit Laserstrahlen verschiedener Wellenlängen.
Deutung:
Laser strahlen Licht bestimmter Wellenlängenbereiche aus, wobei die Länge der Wellen vom violetten zum roten Licht zunimmt (siehe Abbildung). Gleichzeitig sinkt jedoch der Energiegehalt der Photonen, so dass das violette Licht deutlich energiereicher ist als das rote. Unter UV-Licht fluoreszieren alle Lösungen in einer charakteristischen Farbe und emittieren somit Licht einer bestimmten Wellenlänge. Während der energiereichste Laser (violett) alle Lösungen zur Fluoreszenz anregt, ist der grüne Laserstrahl mittlerer Energie lediglich in der Lage, zwei Lösungen zum Leuchten zu bringen, während beim energieärmsten roten Laserstrahl keine der Lösungen fluoresziert. Da weder der grüne noch der rote Laser in der Lage sind, eine grüne bzw. rote Fluoreszenz hervorzurufen, lässt sich folgern, dass die Energie des eingestrahlten Lichts für die Emission von Fluoreszenzlicht größer sein muss, als das emittierte Licht.

Abbildung: Elektromagnetisches Spektrum des sichtbaren Lichts. Links an das Spektrum schließt sich der Bereich der ultravioletten Strahlung an (UV), rechts des Spektrums folgt der Bereich der Infrarotstrahlung (IR).
Anmerkungen zur Deutung des Experiments:
Im Gegensatz zu herkömmlichen „weißen“ Lichtquellen strahlen Laser annähernd monochromatisches Licht einer bestimmten Wellenlänge bzw. eines bestimmten Wellenlängenbereichs aus (violett ~ 405 nm, grün ~ 532 nm, rot ~ 650 nm). Entsprechend der antiproportionalen Beziehung zwischen der Wellenlänge des Lichts und der Energie eines Photons sinkt mit zunehmender Wellenlänge der Energiegehalt der Photonen, so dass das Licht des violetten Lasers energiereicher als das des roten Lasers ist. Für die Anregung verschiedener Fluorophore bedarf es bedingt durch ihre Molekülstruktur eines bestimmten Mindestenergiegehalts. Ähnlich wie bei Molekülen farbiger Substanzen wird nach Absorption einer bestimmten Energiemenge ein Teil der Energie strahlungslos über Translations- und Rotationsbewegungen abgegeben – wobei dieser Anteil gering ist – so dass das emittierte Licht einen geringen Energiegehalt und somit eine größere Wellenlänge als das absorbierte Licht besitzt, was auch als Stokes-Shift bezeichnet wird. Dieser auch als Rotverschiebung bezeichnete Effekt erklärt auch, warum z. B. die Energie eines grünen Laserstrahls nicht ausreicht, um einen im grünen Bereich fluoreszierenden Fluorophor zur Fluoreszenzemission anzuregen.
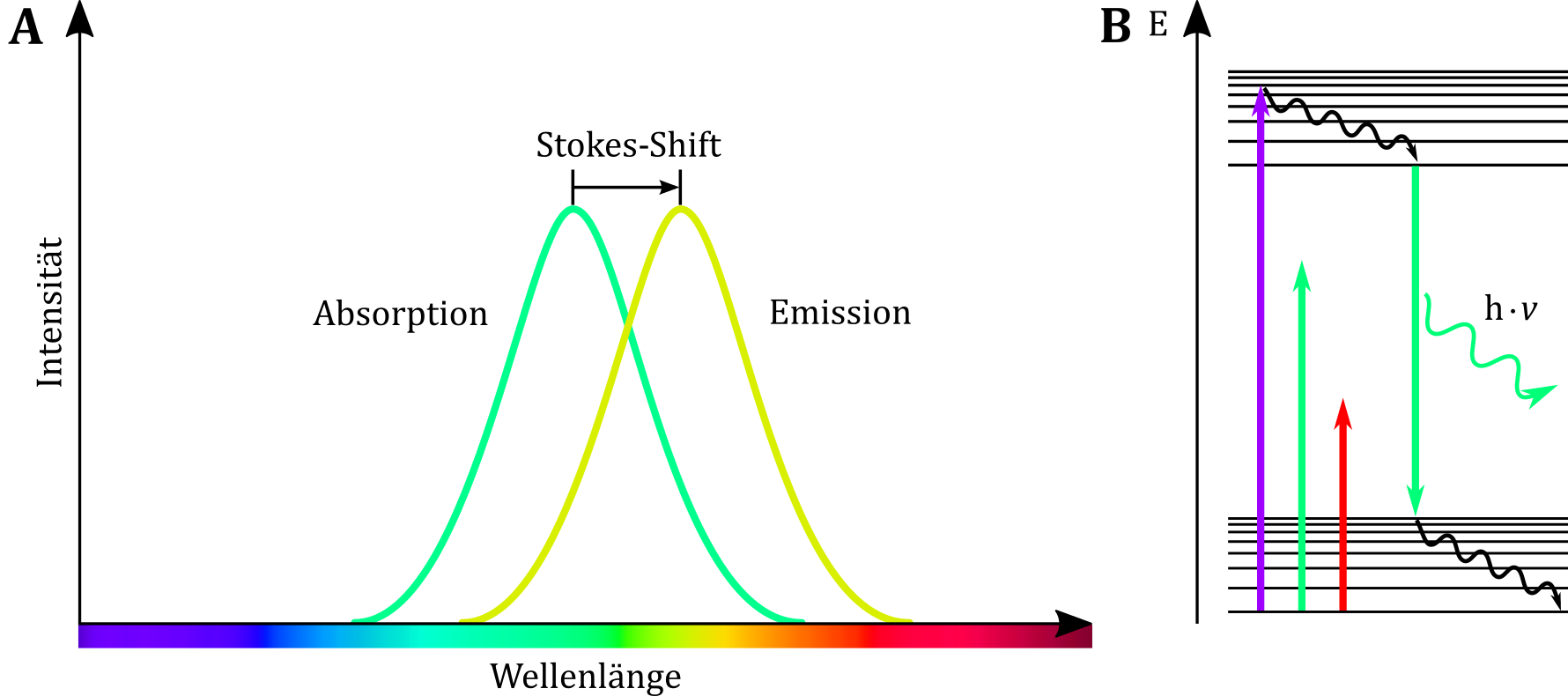
Abbildung: (A) Das Emissionsspektrum ist im Vergleich zum Absorptionsspektrum deutlich rotverschoben. (B) Aufgrund des Stokes-Shift reichen die Energien grüner bzw. roter Wellenlängenbereiche nicht aus, um eine grün fluoreszierende Substanz zur Fluoreszenz anzuregen.
Literatur:
- von Hoff, E. (2020). Entwicklung und Evaluation von Konzepten und Formaten zum Wissenstransfer von der Forschung in die Schule und Öffentlichkeit - Am Beispiel des SFB 803 (Dissertation). Georg-August-Universität Göttingen, Göttingen. Abrufbar unter http://hdl.handle.net/21.11130/00-1735-0000-0005-14C7-4.

