Dieses Experiment kann u. a. im Unterricht eingesetzt werden, um die auftretende Fluoreszenz didaktisch reduziert auf die eingeschränkten Rotationsbewegungen innerhalb des Morinmoleküls zurückzuführen.
Geräte und Chemikalien:
3 Bechergläser (50 mL), Tüpfelplatte, Pasteurpipetten, Spatel, UV-Lampe, demin. Wasser, Aluminiumchlorid Hexahydrat (GHS05), Morin (GHS09), Ethanol (GHS02, GHS07), Essigsäurelösung (1 M; GHS05).
Versuchsdurchführung:
In einem Becherglas wird eine Spatelspitze Morin in 10 mL Ethanol gelöst. Auf eine Tüpfelplatte werden in je ein Feld die Morinlösung, eine Aluminiumchloridlösung sowie Ethanol gegeben und alle drei mit einem Tropfen Essigsäurelösung angesäuert. Anschließend werden sowohl die Aluminiumchloridlösung als auch das Ethanol mit etwas Morinlösung versetzt. Schließlich werden die Lösungen unter UV-Licht betrachtet.
Beobachtung:
Bei Zugabe der Morinlösung intensiviert sich die gelbe Färbung der Aluminiumchloridlösung. Unter UV-Licht ist eine blau-grüne Fluoreszenz zu beobachten, wobei alle anderen Lösungen keine Fluoreszenz zeigen (siehe Abbildung).
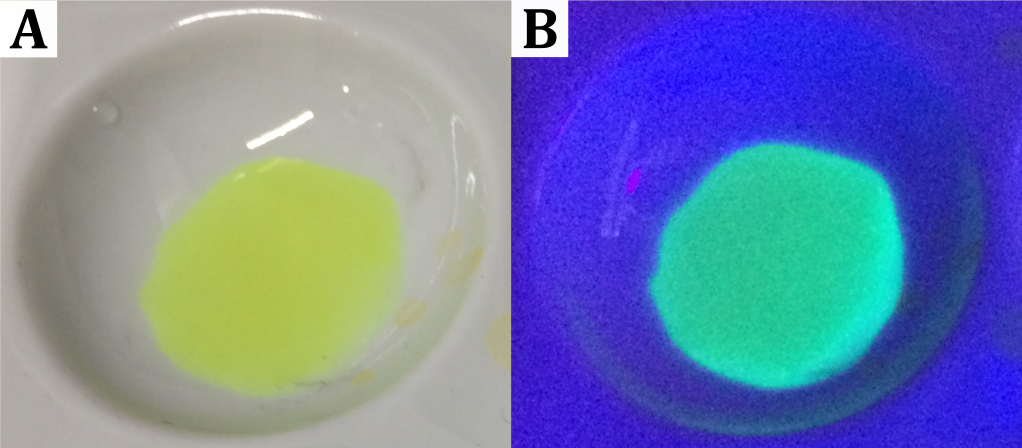
Abbildung: (A) Gelbe Färbung der Lösung bei Tageslicht, (B) blau-grüne Fluoreszenz unter UV-Licht.
Deutung:
Morin bildet in Anwesenheit von Aluminiumionen einen Chelatkomplex, an dem u. a. auch die Resorcingruppe beteiligt ist. Aufgrund der Chelatierung wird die Rotationsfähigkeit des Resorcins eingeschränkt (siehe Abbildung B, rot markierte Bindungsstellen), so dass eine strahlungslose Desaktivierung nur eingeschränkt möglich ist. Entsprechend erfolgt die Energieabgabe in Form von strahlender Desaktivierung, die als Fluoreszenz wahrgenommen werden kann.
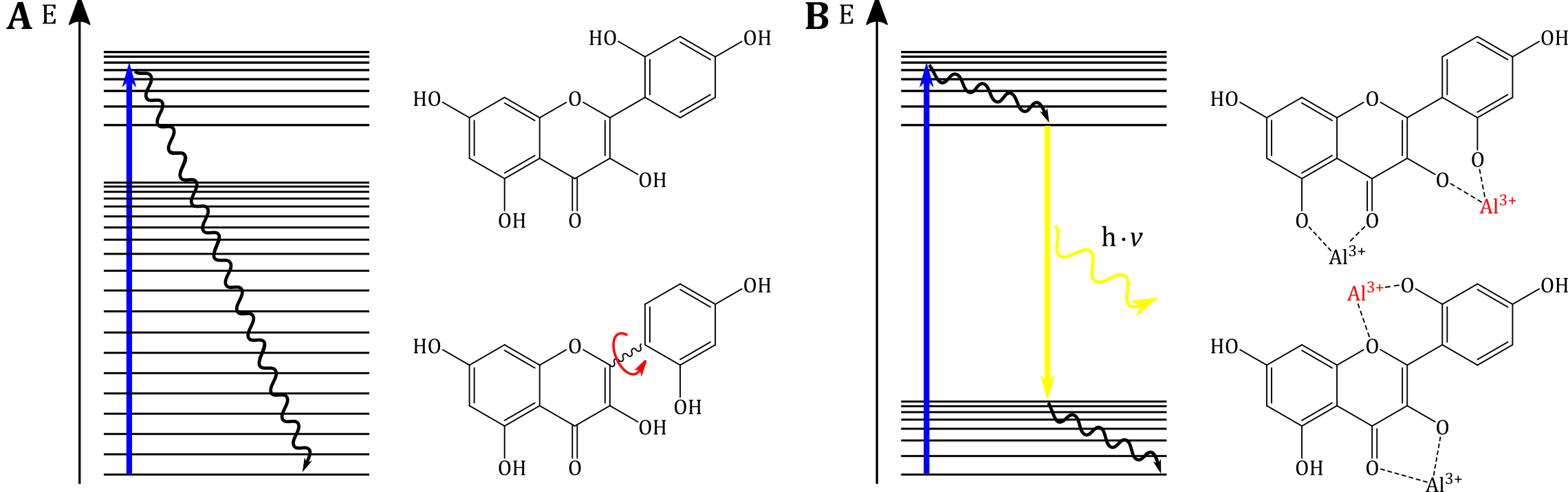
Abbildung: (A) Das Morinmolekül ist zunächst sterisch nicht gehindert, so dass eine Abregung über Schwingungsrelaxation möglich ist. (B) Bzgl. der Chelatierung mit Aluminiumionen werden verschiedene Bindungsstellen vorgeschlagen. Die rot markierten Bindungsstellen verhindern eine Rotation und verringern die Schwingungszustände, so dass eine Abregung mittels Fluoreszenzemission erfolgt.
Anmerkungen zur Deutung des Experiments:
Morin gehört zur Gruppe der Flavonoide, die in der Natur eine wichtige Rolle als Blütenfarbstoffe spielen. Es bildet in Anwesenheit von Aluminiumionen aber auch anderen Zentralteilchen wie Zink-, Kupfer-, Eisen- oder Cadmiumionen Chelatkomplexe aus, die z. T. charakteristisch fluoreszieren. Die Fluoreszenz wird dabei in der Literatur auf intramolekulare Protonentransfers im elektronisch angeregten Zustand (Excited State Intramolecular Proton Transfer, ESIPT) zurückgeführt (Höfener et al., 2013). Für die schulische Verwendung ist jedoch eine didaktische Reduzierung auf die Einschränkung von Rotationsbewegungen innerhalb des Morinmoleküls aufgrund der Chelatierung ausreichend. Diesbezüglich lassen sich in der Literatur verschiedene Vorschläge für die Bindungsstellen sowie die Stöchiometrie der Komplexe in Abhängigkeit vom Lösungsmittel, pH-Wert und dem Zentralatom finden (Jamali et al., 2012; Oter & Aydogdu, 2011; Roy et al., 2016; Paulke et al., 2006). Anhand dieser möglichen Bindungsstellen können sterische Hinderungen bezüglich Rotationsbewegungen diskutiert und im Zusammenspiel mit dem oben gezeigten Beispiel von Phenolphthalein und Fluorescein die Bedeutung des Rotationsvermögens hinsichtlich der Fluoreszenzeigenschaft von Molekülen erarbeitet werden.
Literatur:
- Gerdes, E. (2001). Qualitative anorganische Analyse: Ein Begleiter für Theorie und Praxis (2., korrigierte und überarb. Aufl. 1998, Nachdr). Berlin: Springer.
- Höfener, S., Kooijman, P. C., Groen, J., Ariese, F., & Visscher, L. (2013). Fluorescence behavior of (selected) flavonols: A combined experimental and computational study. Physical Chemistry Chemical Physics : PCCP, 15(30), 12572–12581. DOI: 10.1039/c3cp44267e.
- Jamali, A. A., Tavakoli, A., & Ezzati Nazhad Dolatabadi, J. (2012). Analytical overview of DNA interaction with Morin and its metal complexes. European Food Research and Technology, 235(3), 367–373. DOI: 10.1007/s00217-012-1778-8.
- Oter, O., & Aydogdu, S. (2011). Determination of aluminum ion with morin in a medium comprised by ionic liquid-water mixtures. Journal of Fluorescence, 21(1), 43–50. DOI: 10.1007/s10895-010-0688-z.
- Roy, A. S., Samanta, S. K., Ghosh, P., Tripathy, D. R., Ghosh, S. K., & Dasgupta, S. (2016). Cell cytotoxicity and serum albumin binding capacity of the morin-Cu(ii) complex and its effect on deoxyribonucleic acid. Molecular BioSystems, 12(9), 2818–2833. DOI: 10.1039/C6MB00344C.
- Paulke, A., Schubert-Zsilavecz, M., & Wurglics, M. (2006). Determination of St. John's wort flavonoid-metabolites in rat brain through high performance liquid chromatography coupled with fluorescence detection. Journal of Chromatography. B, Analytical Technologies in the Biomedical and Life Sciences, 832(1), 109–113. DOI: 10.1016/j.jchromb.2005.12.043.
- von Hoff, E. (2020). Entwicklung und Evaluation von Konzepten und Formaten zum Wissenstransfer von der Forschung in die Schule und Öffentlichkeit - Am Beispiel des SFB 803 (Dissertation). Georg-August-Universität Göttingen, Göttingen. Abrufbar unter http://hdl.handle.net/21.11130/00-1735-0000-0005-14C7-4.

