In Anlehnung an Bianco, Torino & Mansy, kann anhand dieses Versuchs die Selbstaggregation zu Mizellen und Vesikeln in Abhängigkeit der geometrischen Form der verwendeten Tenside und Lipide untersucht werden. Die Verwendung von Plastikspritzen als Chromatographiesäulen ermöglicht eine Anwendung sowohl im Unterricht als auch im Schülerlabor.
Geräte und Chemikalien:
Größenausschluss-Chromatographiesäulen (Sephadex G25, VWR), 11 Bechergläser (10x 50 mL und 1x 500 mL), Spatel, Pasteurpipetten, Stativmaterial, pH-Meter, UV-Lampe, Ultraschallgerät, Magnetrührer, demin. Wasser, Fettsäure (Linolen-, Palmitin- oder Ölsäure), Lecithin, Pyranin (GHS07), Natriumhydroxidlösung (0,1 M; GHS05), Salzsäurelösung (0,1 M; GHS05), Spülmittel.
Versuchsdurchführung:
Unter Rühren werden 4 Spatelspitzen Pyranin in 500 mL Wasser gelöst. Der pH-Wert der Lösung wird gemessen und wenn nötig unter Verwendung von Natriumhydroxid- oder Salzsäurelösung auf pH = 8 eingestellt. In 5 Bechergläsern (50 mL) werden jeweils 40 mL der Lösung vorgelegt und die folgenden Chemikalien hinzugegeben: (A) eine Spatelspitze Spülmittel, (B) eine Spatelspitze Lecithin, (C) eine Spatelspitze einer Fettsäure, (D) eine Spatelspitze einer Fettsäure sowie etwas Natriumhydroxidlösung, um den pH-Wert auf pH = 11 einzustellen. Der Lösung im fünften Becherglas (E) wird nichts hinzugefügt. Alle fünf Lösungen werden für 5 Minuten in ein Ultraschallbad gestellt (10 Minuten, falls ein haushaltsübliches Brillenultraschallbad verwendet wird) und im Anschluss für weitere 5 Minuten ruhen gelassen.
Während der Größenauschlusschromatographie werden alle Schritte unter UV-Licht durchgeführt, um die Sichtbarkeit des Pyranins zu erhöhen. Für jede der Lösungen wird eine Säule solange geöffnet, bis die Oberfläche des Säulenmaterials nahezu trocken liegt. Zwei Tropfen der jeweiligen Lösungen werden vorsichtig auf das Säulenmaterial gegeben. Sobald die Lösungen in das Material eingesunken sind, werden einige Tropfen demineralisiertes Wasser hinzugegeben, bis sich eine farbige Bande in der obersten Schicht des Säulenmaterials gebildet hat. Anschließend wird die Säule vorsichtig bis zum Rand mit Wasser gefüllt. Die aus der Öffnung der Säule tropfende Lösung wird aufgefangen, bis die beobachtbare Fluoreszenz ungefähr in der Mitte der Säule angekommen ist. Um den Prozess zu stoppen, wird die Säule an ihrem unteren Ende wieder verschlossen.
Hinweis: Es ist möglich, eine Säule für alle Lösungen zu nutzen (Spülen notwendig!). Die Verwendung unterschiedlicher Säulen ermöglicht es jedoch, die Beobachtungen zu vergleichen.
Beobachtung:
Die leicht gelbe und transparente Pyraninlösung leuchtet gelb bis grün unter UV-Licht. Nach der Behandlung im Ultraschallbad liegen in den Bechergläsern A bis D Suspensionen vor, während die Lösung in Glas E transparent bleibt. Für die verschiedenen Lösungen formen sich in den Säulen unterschiedliche fluoreszierende Banden: (A) eine Bande, (B) zwei Banden, (C), zwei Banden, (D), eine Bande, (E) eine Bande (siehe Abbildung).
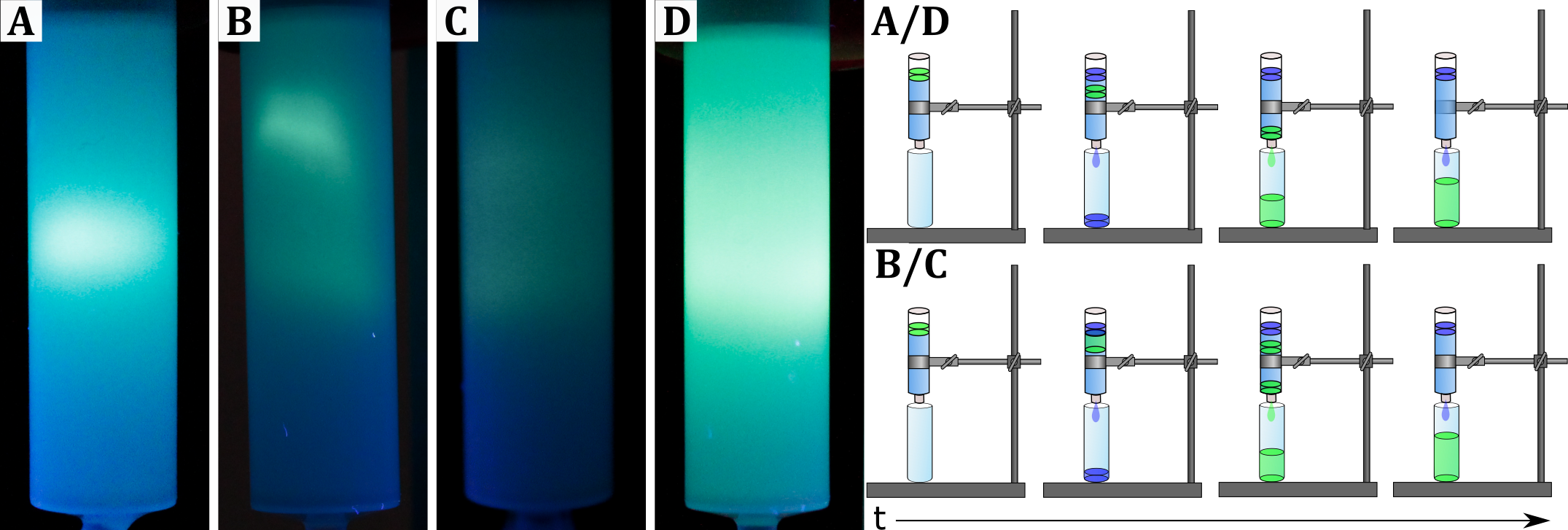
Abbildung: Größenausschluss-Chromatographiesäulen (Sephadex 25) unter UV-Licht von A) Pyraninlösung + Spülmittel, B) Pyraninlösung + Lecithin, C), Pyraninlösung + Ölsäure (pH = 8) und D) Pyraninlösung + Ölsäure (pH = 11) (von Hoff et al., 2019).
Deutung:
Beim Lösen von Spülmittel, Lecithin und Fettsäuren in den angefärbten Lösungen entstehen supramolekulare Aggregate mit Größen im Nanometerbereich. Dabei kann die Bildung der Aggregate auf die amphiphilen Eigenschaften der jeweiligen Moleküle zurückgeführt werden. Während der Säulenchromatografie werden die verschiedenen Bestandteile der Lösung vor allem aufgrund ihrer Größe aufgetrennt. Die erste Säule mit der Tensidlösung zeigt nur eine fluoreszierende Bande. Tensidmoleküle in Wasser bilden bekanntermaßen Mizellen, die auf der Säule nicht sichtbar von anderen Bestandteilen der Lösung getrennt werden können. Entsprechend ist nur eine fluoreszierende Bande zu sehen, die auf die enthaltenen Pyraninmoleküle zurückgeführt werden kann. Lecithin besitzt zwei hydrophobe Ketten und ist damit zu voluminös, um Mizellen zu formen, so dass stattdessen Vesikel entstehen. Während der Aggregation zu Vesikeln wird wässrige Pyraninlösung im Inneren der Hohlkugeln eingeschlossen, was dazu führt, dass zwei fluoreszierende Banden entstehen – die untere enthält die deutlich größeren Vesikel, die obere die frei vorliegenden Pyraninmoleküle (siehe Abbildung).
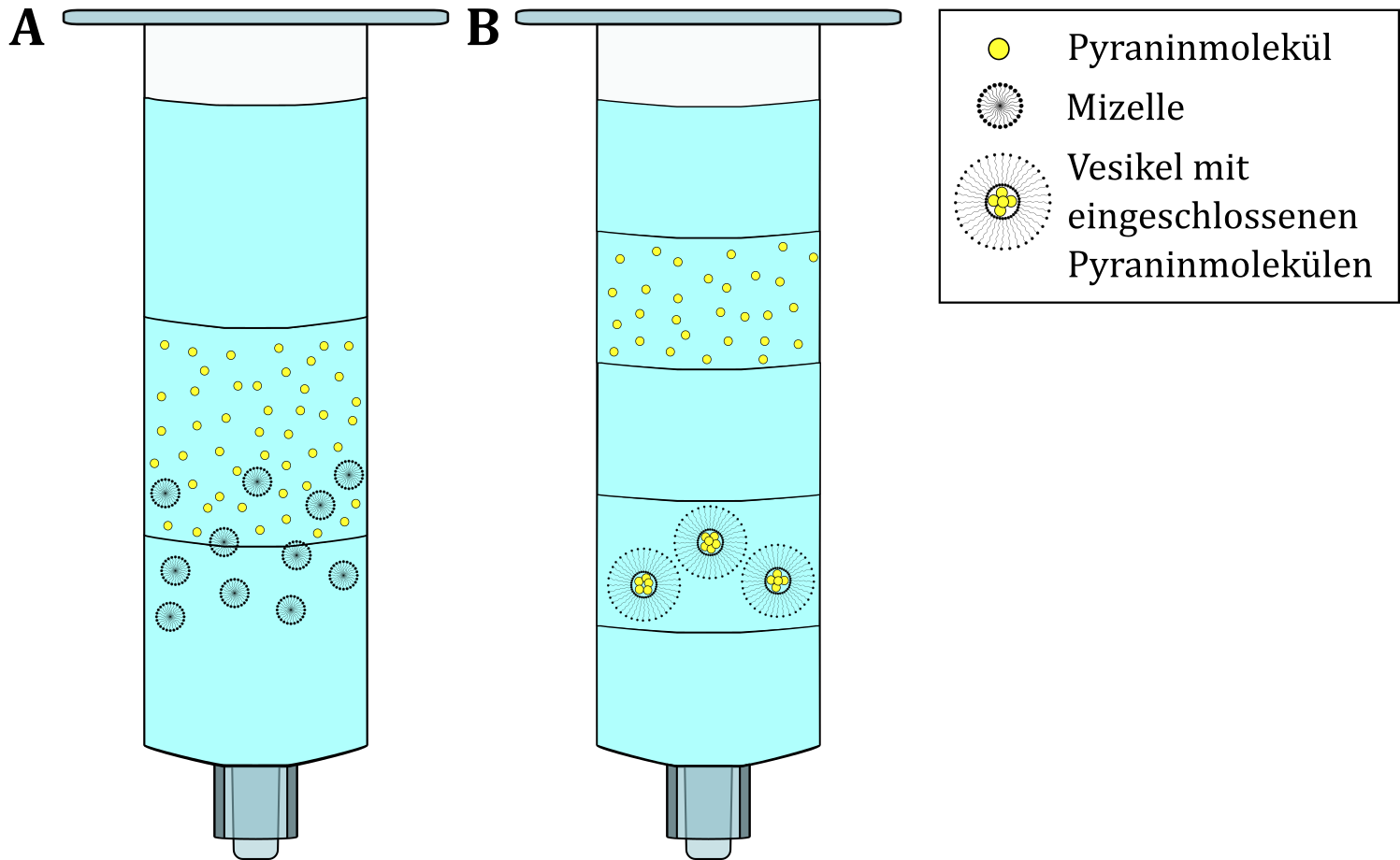
Abbildung: Schematische Darstellung der Auftrennung der Moleküle in den jeweiligen Säulen. (A) Lösungen A und D, (B) Lösungen B und C (von Hoff et al, 2019).
In Abhängigkeit vom pH-Wert der Fettsäurelösungen treten sowohl eine (pH = 11) als auch zwei Banden (pH = 8) auf. Das lässt darauf schließen, dass der pH-Wert einen Einfluss auf die Aggregation der Moleküle hat, was zur Bildung von sowohl Mizellen als auch Vesikeln führt. Die letzte Lösung ohne weitere Zusätze zeigt nur eine Bande, da hier lediglich der Farbstoff enthalten ist.
Anmerkungen zur Deutung des Experiments:
Die geometrische Form der Aggregate amphiphiler Moleküle hängt stark vom Packungsparameter der Monomere ab. Fettsäuren besitzen im Gegensatz zu Lipiden wie den Lecithinen nur eine hydrophobe Kette, was ihnen eine eher konische Geometrie verschafft. Dennoch zeigen die hier genannten Fettsäuren in Abhängigkeit vom pH-Wert unterschiedliche Aggregate. Bei einem pH-Wert >10 liegen die Fettsäuren vollständig deprotoniert vor. Die geladenen Kopfgruppen sorgen dabei für eine stark konische Form und somit für die Bildung von Mizellen. Im pH-Bereich von 7-10 liegen die Fettsäuren nur partiell deprotoniert vor, was die Ausbildung von Wasserstoffbrückenbindungen zwischen zwei Fettsäuremolekülen ermöglicht (siehe untere Teilabbildung A). Die entstehenden Dimere ähneln geometrisch Lipiden mit zwei hydrophoben Ketten, die insgesamt eine eher zylindrische Geometrie besitzen, was wiederum die Bildung von Vesikeln erklärt.
Typischerweise wird die Bildung amphiphiler Aggregate lediglich in Bezug auf Tenside und Waschprozesse im Chemieunterricht behandelt. Dieselben Konzepte spielen jedoch auch in biologischen Kontexten wie bei der Bildung von Lipiddoppelschichten eine wichtige Rolle, so dass interdisziplinäre Bezüge bspw. zum vesikulären Transport von Neurotransmittern am synaptischen Spalt hergestellt werden können. Zudem bietet die Verwendung herkömmlicher Plastikspritzen als Chromatographiesäulen die Möglichkeit, das Verfahren der Größenausschluss-Chromatographie, das in der biochemischen Forschung häufig zur Aufreinigung von Proteinen sowie hier beschrieben zur Trennung von Vesikeln verwendet wird, auch in schulischen Kontexten anzuwenden
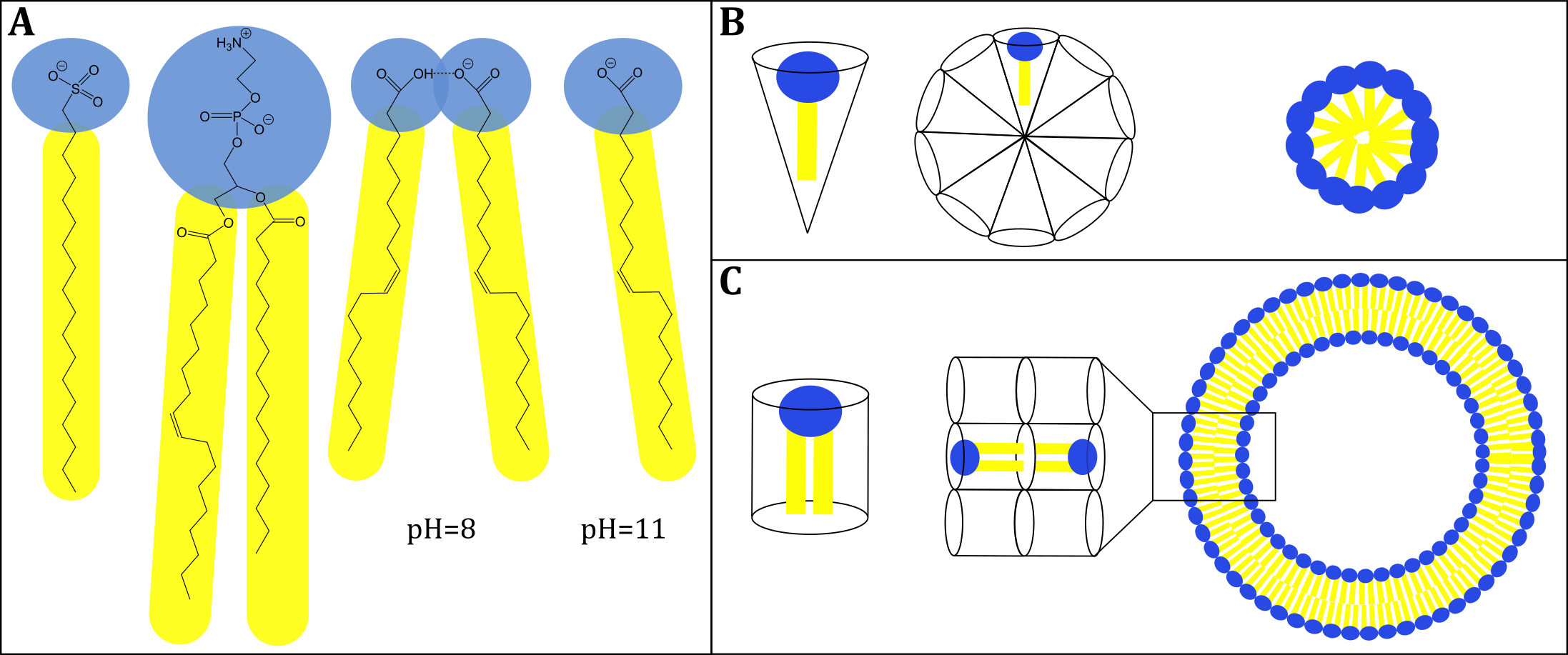
Abbildung: (A, von links nach rechts) Typisches Sulfonat-Tensid, Phosphocholin-Lipid, Ölsäuredimer bei pH = 8, deprotoniertes Ölsäuremonomer bei pH = 11. (B) Darstellung eines Tensids mit konischer Geometrie das Mizellen bildet. (C) Darstellung eines zylindrischen Lipids, das Vesikel bildet (von Hoff et al., 2019).
Literatur:
- Bianco, C. D., Torino, D., & Mansy, S. S. (2014). Vesicle Stability and Dynamics: An Undergraduate Biochemistry Laboratory. Journal of Chemical Education, 91(8), 1228–1231. DOI: 10.1021/ed400105q.
- von Hoff, E., Toy, S., Waitz, T., & Mey, I. (2019). Experiment on the Self-Aggregation of Amphiphiles. World Journal of Chemical Education, 7(2), 185–188. DOI: 10.12691/wjce-7-2-19.
- von Hoff, E. (2020). Entwicklung und Evaluation von Konzepten und Formaten zum Wissenstransfer von der Forschung in die Schule und Öffentlichkeit - Am Beispiel des SFB 803 (Dissertation). Georg-August-Universität Göttingen, Göttingen. Abrufbar unter http://hdl.handle.net/21.11130/00-1735-0000-0005-14C7-4.

