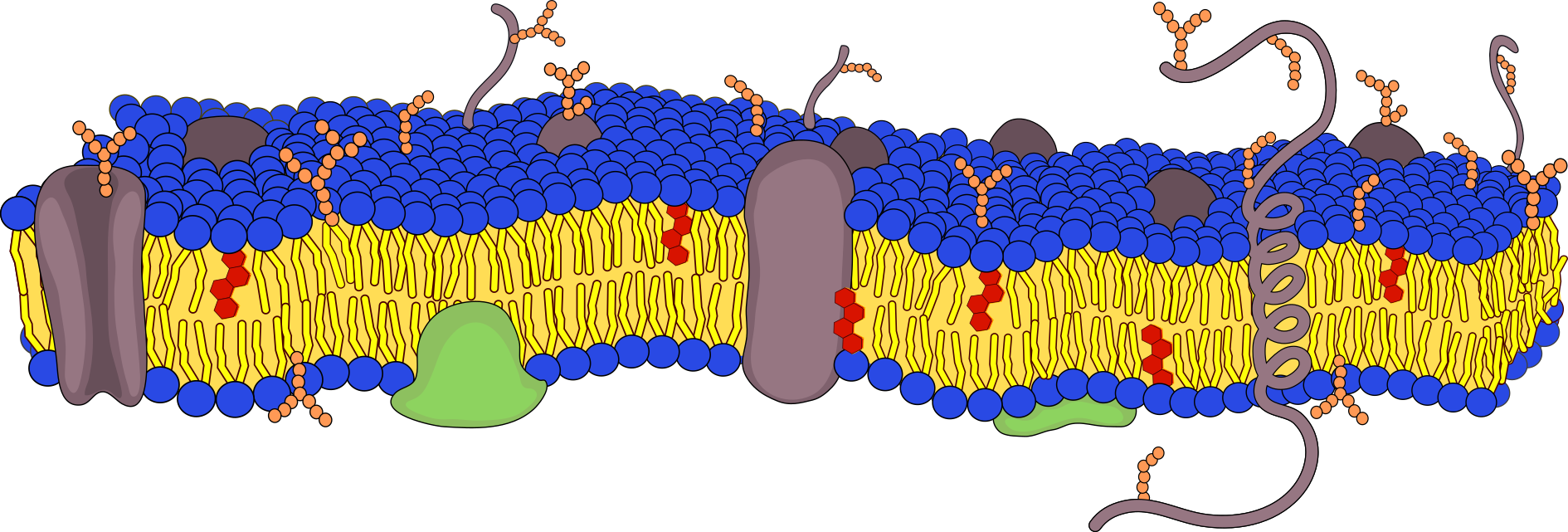
Eigenschaften von Bestandteilen einer Biomembran – Makroskopische Untersuchung
Die Untersuchung der Eigenschaften roter Zwiebelhäute in verschiedenen Reagenzien ermöglicht es, im zeitlichen Rahmen einer Schulstunde auf verschiedene Bestandteile von Biomembranen zu schließen.
Geräte und Chemikalien:
11 Reagenzgläser mit Stopfen, Reagenzglasständer, Skalpell, Pinzette, Ethanol (GHS02, GHS07), demin. Wasser, Spülmittellösung, Öl, Essigessenz, Eiklar, Magainin 2, rote Zwiebel.
Versuchsdurchführung:
Zunächst wird ein ca. 1 cm2 großes Stück der Haut einer roten Zwiebel mit einer Pinzette abgezogen. Die Zwiebelhaut wird mit einem Skalpell in fünf Streifen geschnitten und zum Auswaschen des roten Zwiebelsafts an den Schnittkanten in ein Reagenzglas mit Wasser gegeben. Dieses wird anschließend eine Minute lang geschüttelt, das Wasser wird getauscht und der Vorgang nochmals wiederholt. Anschließend werden zehn Proben, fünf Reagenzgläser mit Zwiebelhaut und fünf ohne, entsprechend Tabelle 8 vorbereitet.
Tabelle: Ansätze für die Versuchsreihe mit und ohne Zugabe von Zwiebelhaut.
| Reagenzgläser mit Zwiebelhaut | Reagenzgläser mit Vergleichsproben |
| (1) 4 mL Leitungswasser | 6) 4 mL Wasser + 1 mL Öl |
| (2) 4 mL Spülmittellösung | 7) 4 mL Seifenlösung + 1 mL Öl |
| (3) 4 mL Ethanol | (8) 4 mL Ethanol + ca. 1 mL Eiklar |
| (4) 4 mL Essigessenz | (9) 4 mL Essigessenz + ca. 1 mL Eiklar |
| (5) 4 mL Magainin-2-lösung (4 μM; optional) | (10) 4 mL Essigessenz + 1 mL Öl |
Beobachtung:
Reagenzglas (1) zeigt keine Veränderung, die flüssige Phase bleibt farblos, die Zwiebelhaut behält die lila-rötliche Farbe. Die Lösungen in den Reagenzgläsern (2) bis (5) färben sich lila-rötlich, die Zwiebelhäute entfärben sich. Die Flüssigkeiten in den Reagenzgläsern (6) und (10) zeigen eine klare Phasengrenze. In Reagenzglas (7) bilden sich ebenfalls zwei Phasen, wobei die untere Phase kleine gelbliche Tröpfchen beinhaltet. In den Reagenzgläsern (8) und (9) ist zudem jeweils die Bildung eines weißen Feststoffs zu beobachten (siehe Abbildung).

Abbildung: (A, B) Präparation von Zwiebelhäuten. (C, D) Lösungen entsprechend der Tabelle, links Proben mit Zwiebelhäuten, rechts Vergleichslösungen.
Deutung:
Zellmembranen bestehen aus Lipiden und Proteinen und wirken als Barriere, welche das Zellinnere von der Umgebung separiert. Eine Permeabilisierung der Vakuolenmembran kann durch Reaktionen bzw. Wechselwirkungen der Lipide oder Proteine mit verschiedenen Substanzen erfolgen. (RG1) zeigt keine Veränderung da die Membran intakt bleibt und nichts aus dem Zellinneren austreten kann. In (RG2) bis (RG5) zeigt die deutliche Färbung der Lösung, sowie die Entfärbung der Zwiebelhäute, dass die Vakuolenmembran permeabilisiert oder zerstört wurde und der Zellsaft in die umgebende wässrige Phase austreten kann.
Tabelle: Schlussfolgerungen bezüglich der Wirkung verschiedener Substanzen auf Lipidmembranen.
| Probe | Referenz | Schlussfolgerung |
| RG1 | RG6 | Die Lipidmembran kompartimentiert das rote Zellinnere durch hydrophile und hydrophobe Wechselwirkungen, wie es durch die Phasengrenze in RG6 verdeutlicht wird. |
| RG2 | RG7 | RG7 zeigt, dass Tenside Öl in wässriger Umgebung emulgieren können. Durch die Wechselwirkung des Tensids mit den öl-ähnlichen, hydrophoben Ketten der Lipide in der Vakuolenmembran werden diese aus der Membran herausgelöst und die Membran hierdurch zerstört. In der Folge tritt der Zellsaft aus der Vakuole aus. |
| RG3 | RG8 | Durch Vergleich mit RG8 wird gezeigt, dass Ethanol die Proteine der Membran denaturiert, daher tritt in RG3 der Zellsaft ebenfalls aus. |
| RG4 | RG9 RG10 | Die Reaktion von Essigessenz mit Eiklar in RG9 zeigt, dass denaturiertes Protein ausfällt. Schlussfolgernd reagieren in RG4 die Proteine in der Vakuolenmembran mit der Essigessenz und werden denaturiert. Hierdurch entstehen Fehlstellen in der Membran, in deren Folge der Zellsaft in die umgebende wässrige Phase austreten kann. Der Vergleich mit RG 10 zeigt zudem, dass Essigessenz im Gegensatz zu Tensiden die Lipidbestandteile der Vakuolenmembran nicht aus der Membran löst. |
| RG5 | Bei Magainin 2 handelt es sich um ein antimikrobielles Peptid, das Kanäle in der Lipidmatrix der Vakuolenmembran bildet (Iumara et al., 2008; Neubacher et al., 2015). Diese Kanäle sind nicht spezifisch, weshalb der Vakuolensaft durch sie austreten kann und chemische Gradienten über die Membran hinweg zusammenbrechen. Dieser Mechanismus ist eine Möglichkeit für die Wirkung moderner Antibiotika auf Basis von Oligopeptiden. |
Literatur:
- von Hoff, E., Milsch, N., Ehlers, M., Waitz, T., & Mey, I. (2017). Membranforschung für die Öffentlichkeit: Ein Kooperationsprojekt zwischen Fachdidaktik und Fachwissenschaft. CHEMKON, 24(4), 165–169. DOI: 10.1002/ckon.201790002.
- von Hoff, E. (2020). Entwicklung und Evaluation von Konzepten und Formaten zum Wissenstransfer von der Forschung in die Schule und Öffentlichkeit - Am Beispiel des SFB 803 (Dissertation). Georg-August-Universität Göttingen, Göttingen. Abrufbar unter http://hdl.handle.net/21.11130/00-1735-0000-0005-14C7-4.
- Imura, Y., Choda, N., & Matsuzaki, K. (2008). Magainin 2 in action: Distinct modes of membrane permeabilization in living bacterial and mammalian cells. Biophysical Journal, 95(12), 5757–5765. DOI: 10.1529/biophysj.108.133488.
- Neubacher, H., Mey, I., Carnarius, C., Lazzara, T. D., & Steinem, C. (2014). Permeabilization assay for antimicrobial peptides based on pore-spanning lipid membranes on nanoporous alumina. Langmuir : The ACS Journal of Surfaces and Colloids, 30(16), 4767–4774. DOI: 10.1021/la500358h.

