Bei dieser für SuS adaptierten Forschungsmethode zur Herstellung von Vesikeln können entweder die Lipide aus der Lipidextraktion aus Eigelb oder käuflich erworbenes Egg PC verwendet werden. Eine Durchführung der Synthese ist grundsätzlich auch im Unterricht denkbar, eignet sich aufgrund der hohen Wartezeiten jedoch eher für ein Schülerlabor.
Geräte und Chemikalien:
3 Bechergläser, Reagenzglas, Reagenzglasständer, Glasrührstab, Stativmaterial, Pasteurpipette, Kolbenhubpipette, Wasserbad, Heizplatte, Thermometer, Objektträger mit Vertiefung, Licht- oder Fluoreszenzmikroskop, demin. Wasser, n-Heptan (GHS02, GHS07, GHS08, GHS09), Lecithin (Experiment 6.1a oder Egg PC), Saccharoselösung (1 M), Glucoselösung (1 M), Texas Red DHPE (1,2-Dihexadecanoyl-sn-Glycero-3-Phosphoethanolamin; optional).
Versuchsdurchführung:
Unter dem Abzug werden in einem Becherglas 0,2 g Lecithin in 3 mL n-Heptan gelöst. 2,75 mL der Lösung werden in ein Reagenzglas überführt und in einem Wasserbad langsam auf 30 °C erhitzt. Mithilfe einer Pasteurpipette wird vorsichtig ein Stickstoffgasstrom auf die Lösung gerichtet, um das Lösungsmittel zu verdampfen. Nach dem Verblasen des Lösungsmittels werden 5 mL Saccharoselösung in das Reagenzglas gegeben und dieses für 60 Minuten ruhen gelassen. Daraufhin werden 15 µL Glucoselösung in die Vertiefung eines Objektträgers gegeben und weitere 15 µL der Lecithinlösung hinzupipettiert. Anschließend wird die Probe unter dem Mikroskop betrachtet.
Optional: Für die Fluoreszenzmarkierung des Lipidfilms kann eine 0,7 M Texas Red-Lösung in n-Heptan hergestellt und 38 μL der Texas Red-Lösung zu Beginn mit den 2,75 mL der Lecithinlösung gemischt werden. Anschließend wird in gleicher Weise wie mit der reinen Lecithinlösung verfahren und die Probe schließlich unter einem Fluoreszenzmikroskop betrachtet.
Beobachtung:
Im Falle der Zugabe von Texas Red-Lösung bleibt nach dem Verdampfen des Lösungsmittels ein leicht rötlicher Feststoff an der Gefäßwand zurück. Der Rückstand löst sich nach Zugabe der Saccharoselösung vom Gefäßrand ab und die Lösung trübt sich leicht. Unter dem Mikroskop sind kleine, blasenartige runde Strukturen zu erkennen, die bei Anregung mit grünem Licht rot fluoreszieren (siehe Abbildung).
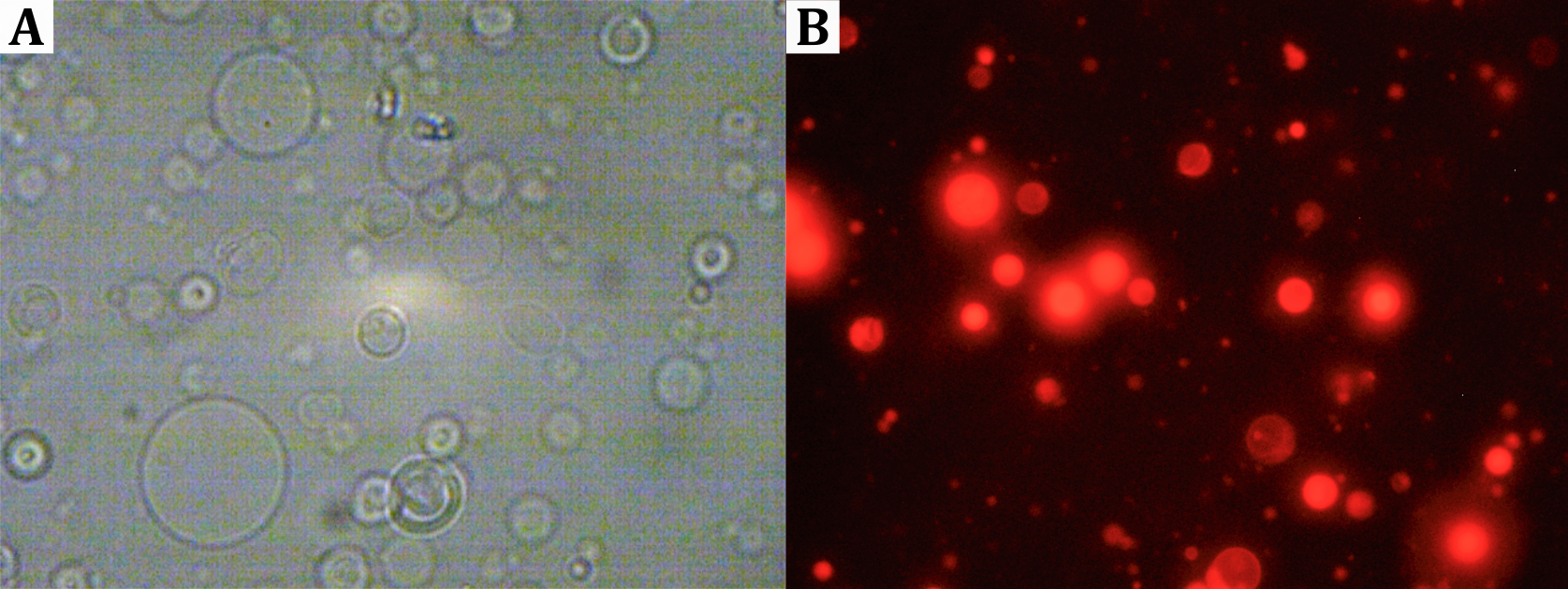
Abbildung: (A) Durchlichtmikroskopische Aufnahmen von Vesikeln. (B) Fluoreszenzmikroskopische Aufnahmen Texas Red-markierter Vesikel.
Deutung:
Lecithin löst sich in n-Heptan und bei Zugabe von Texas Red verteilt sich dieses homogen in der Lösung. Nach dem Verblasen des Lösungsmittels bleiben geordnete Lipidfilme an der Reagenzglaswand zurück. Bei Zugabe der Saccharoselösung lösen sich einzelne Lipidschichten von der Gefäßwand ab und lagern sich aufgrund des hydrophoben Effekts zu Vesikeln zusammen. Die Vesikel sind dabei so groß, dass sie unter dem Mikroskop betrachtet werden können. Die verschiedenen Brechungsindizes der Saccharoselösung im Inneren der Vesikel und der Glucoselösung als Außenmedium erleichtern die Betrachtung der Vesikel insbesondere unter dem Lichtmikroskop (Stein et al., 2017).
Anmerkungen zur Deutung:
Bitte beachten Sie die Anmerkungen zur Deutung der Experimente im separten Beitrag.
Litertaur:
- von Hoff, E., Milsch, N., Ehlers, M., Waitz, T., & Mey, I. (2017). Membranforschung für die Öffentlichkeit: Ein Kooperationsprojekt zwischen Fachdidaktik und Fachwissenschaft. CHEMKON, 24(4), 165–169. DOI: 10.1002/ckon.201790002.
- Akashi, K., Miyata, H., Itoh, H., & Kinosita, K. (1996). Preparation of giant liposomes in physiological conditions and their characterization under an optical microscope. Biophysical Journal, 71(6), 3242–3250. DOI: 10.1016/S0006-3495(96)79517-6.
- Stein, H., Spindler, S., Bonakdar, N., Wang, C., & Sandoghdar, V. (2017). Production of Isolated Giant Unilamellar Vesicles under High Salt Concentrations. Frontiers in Physiology, 8, 63. DOI: 10.3389/fphys.2017.00063.
- von Hoff, E. (2020). Entwicklung und Evaluation von Konzepten und Formaten zum Wissenstransfer von der Forschung in die Schule und Öffentlichkeit - Am Beispiel des SFB 803 (Dissertation). Georg-August-Universität Göttingen, Göttingen. Abrufbar unter http://hdl.handle.net/21.11130/00-1735-0000-0005-14C7-4.

